Questão 01 sobre Gás Ideal: (UFV-MG–2008) Uma quantidade fixa de um gás real se comporta cada vez mais como um gás ideal se:
A) aumentarmos a sua pressão e a sua temperatura.
B) diminuirmos a sua pressão e a sua temperatura.
C) aumentarmos a sua pressão e diminuirmos a sua temperatura.
D) diminuirmos a sua pressão e aumentarmos a sua temperatura.
Questão 02. (Mackenzie-SP–2007) Um cilindro metálico de 41 litros contém argônio (massa de um mol = 40 g) sob pressão de 90 atm à temperatura de 27 °C. A massa de argônio no interior desse cilindro é de:
Dado: R = 0,082 atm.L/(mol.K)
A) 10 kg.
B) 9 kg.
C) 8 kg.
D) 7 kg.
E) 6 kg.
Questão 03. (UFLA-MG–2006) Certa quantidade de um gás ideal está contida em um recipiente de paredes rígidas e volume V, inicialmente à temperatura T1 = 400 K e exercendo uma pressão P1 = 1,0 x 106 N/m2. Utiliza-se parte desse gás, de forma que a pressão baixe para P2 = 6,0 x 105 N/m2 e a temperatura para T2 = 300 K.
Pode-se afirmar que a quantidade de gás utilizada foi de:
A) 25%.
B) 20%.
C) 80%.
D) 40%.
Questão 04 sobre Gás Ideal: (UFC) Um gás ideal sofre o processo cíclico mostrado no diagrama P x T, conforme a figura a seguir. O ciclo é composto pelos processos termodinâmicos a → b, b → c e c → a.
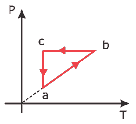
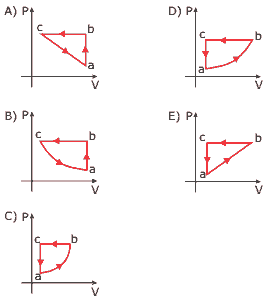
Assinale, entre as alternativas a seguir, aquela que contém o diagrama P x V equivalente ao ciclo P x T.
Questão 05. (CEFET-MG–2009) Pela teoria cinética dos gases, a pressão de um gás está relacionada à sua temperatura T, ao volume V por ele ocupado, à massa m, ao número N e à velocidade quadrática média vM de suas moléculas. Um gás terá sua pressão aumentada se:
A) N diminuir e m diminuir.
B) T diminuir e V aumentar.
C) V aumentar e N diminuir.
D) vM diminuir e T aumentar.
E) m aumentar e vM aumentar.
Questão 06. (UFV-MG) Dez mol de um gás perfeito sofrem uma transformação ABC, como mostrado no diagrama; p representa a pressão do gás, V o seu volume e T a temperatura absoluta, sendo TA, TB e TC as temperaturas nos estados A, B e C, respectivamente. Pode-se afirmar CORRETAMENTE que:
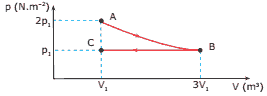
A) TB = TC.
B) TC = 6TA.
C) TA = 3TB.
D) TB = 2TA.
E) 2TB = 3TA.
Questão 07 sobre Gás Ideal: (EFOA-MG) Os gráficos a seguir ilustram transformações termodinâmicas de uma massa constante de um gás ideal, relacionando as variáveis de estado termodinâmico, pressão P, volume V e temperatura T.
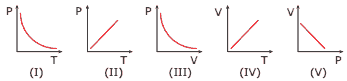
Dos gráficos anteriores, aqueles que podem representar os processos isotérmico, isobárico e isovolumétrico são, respectivamente:
A) I, II e III.
B) II, III e IV.
C) III, IV e II.
D) I, III e V.
E) III, II e V.
Questão 08. (UFMG) Um mergulhador, na superfície de um lago onde a pressão é de 1,0 atm, enche um balão com ar e então desce a 10 m de profundidade. Ao chegar nessa profundidade, ele mede o volume do balão e vê que este foi reduzido a menos da metade. Considere que, dentro da água, uma variação de 10 m na profundidade produz uma variação de 1 atm de pressão.
Se TS é a temperatura na superfície e TP a temperatura a 10 m de profundidade, pode-se afirmar que:
A) TS < TP.
B) TS = TP.
C) TS > TP.
D) não é possível fazer comparação entre as duas temperaturas com os dados fornecidos.
Questão 09. (UFU-MG–2009) O gráfico a seguir ilustra a pressão de um gás ideal em função do seu volume durante uma expansão isotérmica de um estado inicial A até um estado final B. Das alternativas a seguir, a que CORRETAMENTE representa o volume final VB é:
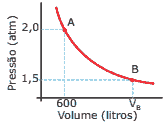
A) 600 litros
B) 1 200 litros
C) 800 litros
D) 1 800 litros
Questão 10 sobre Gás Ideal: Modelo Enem. Seja um mol de um gás ideal a uma temperatura de 400 K e à pressão atmosférica p0. Esse gás passa por uma expansão isobárica até dobrar seu volume. Em seguida, esse gás passa por uma compressão isotérmica até voltar a seu volume original.
Qual a pressão ao final dos dois processos?
A) 0,5p0
B) 1,0p0
C) 2,0p0
D) 5,0p0
E) 10,0p0
🔵 >>> Verifique todos os nossos exercícios e atividades de Física.
Gabarito com as respostas das questões de Física sobre Gás Ideal:
01. D;
02. E;
03. B;
04. B;
05. E;
06. E;
07. C;
08. C;
09. C;
10. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
