Questão 01. (Uel PR/2007) Exercícios sobre Volume: O dióxido de carbono, gerado pelos tripulantes em uma atmosfera artificial de um submarino ou de uma cápsula espacial, deve ser removido e o gás oxigênio recuperado. O superóxido de potássio é um composto interessante para ser utilizado com este propósito porque reage com o dióxido de carbono liberando o oxigênio, de acordo com a reação:
![]()
Considerando a reação (equação não balanceada) e os compostos que dela participam, é correto afirmar:
a) Esta reação ocorre com facilidade porque é uma reação entre um óxido ácido (KO2) e um óxido básico (CO2).
b) Os coeficientes estequiométricos, na ordem em que as substâncias aparecem na equação, após correto balanceamento, são 2, 3, 2, 4.
c) Se forem exalados 160,0 litros de CO2, sob condições de 760,0 mmHg e 25 ºC, a massa de KO2 necessária para consumir todo o CO2 é de 1360 g.
d) Para uma massa de 4350 g de KO2, o volume de O2 produzido, sob condições de 1,500 atm e 28 ºC, é de aproximadamente 755,3 litros.
e) Para qualquer massa de KO2 utilizada, os volumes de CO2 consumido e de O2 liberado, nas mesmas condições de pressão e temperatura, serão iguais.
Questão 02. – (Mackenzie SP/2007) 2007 é considerado pela UNESCO como o ano Heliofísico. O Sol é responsável pelos ventos, pela formação das nuvens e pela chuva. Graças a ele, a água evapora, as plantas fazem fotossíntese, crescem e fornecem madeira, que dá origem ao carvão usado como combustível em termelétricas.
Nota: considere o carvão como sendo constituído somente por carbono.
Dado: massa molar C = 12 g/mol.
Do texto acima, é INCORRETO afirmar que:
a) cita duas reações químicas de comportamento antagônico em termos de contribuição para o efeito estufa.
b) cita a ocorrência de fenômenos físicos.
c) o gás oxigênio é o comburente na combustão de carvão.
d) o volume de ar necessário, medido nas condições normais de temperatura e pressão, na combustão total de 12 T de carvão, é de 11,2x107 L.
e) são citadas somente reações químicas que contribuem para minimizar o efeito estufa.
Questão 03. (UFRural RJ/2007)
“Com o preço do petróleo se aproximando de US$ 80 por barril, o bioprocessamento talvez nem precise esperar por formas de vida desenvolvidas do zero. A GreenFuel, em Cambridge, Massachusetts, instalou fazendas de algas em usinas elétricas para converter até 40% do CO2 expelido em matéria-prima de biocombustíveis. A empresa afirma que uma grande fazenda de algas junto a uma usina de 1 GW poderia produzir cerca de 190 milhões de litros de etanol por ano.”
(Extraída de American Scientific Brasil,
Edição nº 53 – outubro de 2006.)
Essa transformação se dá por um processo global que pode ser descrito a seguir:
![]()
Calcule o volume de gás carbônico retirado da atmosfera, em litros, no período de um ano.
Dados :
Densidade o etanol = 0,8 g/cm3
Volume molar = 24,5 L. mol–1
Questão 04. (Fuvest SP/2006/1ªFase) Com a chegada dos carros com motor Flex, que funcionam tanto com álcool quanto com gasolina, é importante comparar o preço do litro de cada um desses combustíveis. Supondo-se que a gasolina seja octano puro e o álcool, etanol anidro, as transformações que produzem energia podem ser representadas por:
C8H18(l) + 25/2 O2(g) ® 8CO2(g) + 9H2O(g) + 5100kJ
C2H5OH(l) + 3 O2(g) ® 2CO2(g) + 3H2O(g) + 1200kJ
Considere que, para o mesmo percurso, idêntica quantidade de energia seja gerada no motor Flex, quer se use gasolina, quer se use álcool. Nesse contexto, será indiferente, em termos econômicos, usar álcool ou gasolina se o quociente entre o preço do litro de álcool e do litro de gasolina for igual a:
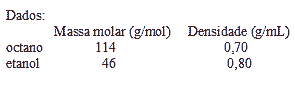
a) 1/2
b) 2/3
c) 3/4
d) 4/5
e) 5/6
Questão 05. (Ufmt MT/2006/1ªFase) Exercícios sobre Volume: Os automóveis modernos estão equipados com saco de ar para proteger os ocupantes no caso de colisão. Muitos sacos de ar são inflados com nitrogênio N2, gás liberado na reação muito rápida entre a azida de sódio, NaN3 e o óxido de ferro (III) iniciada por centelha elétrica. A reação não balanceada é:
![]()
Qual é o volume aproximado de nitrogênio gasoso produzido, nas CNTP, quando reagem 260 g de NaN3?
a) 75 L
b) 134 L
c) 350 L
d) 80 L
e) 22 L
Questão 06. (Ufu MG/2006/1ªFase) O trióxido de enxofre é um dos óxidos responsáveis pelo fenômeno da chuva ácida, proveniente da queima de combustíveis fósseis nos motores dos veículos.
A respeito do trióxido de enxofre, marque a alternaiva correta.
Dados: (CNTP): T = 273 K e P = 760 mmHg
a) Ao reagir 16 g de SO3 com 5 g de água haverá excesso de SO3.
b) A equação que representa a formação do ácido proveniente do SO3 é:
![]()
c) O volume ocupado por 240 g de SO3 nas CNTP é, aproximadamente, 67,2 L.
d) O ácido formado ao reagir o trióxido de enxofre com a água é um hidrácido.
Questão 07. (Uff RJ/2006/2ªFase) Na calcinação de 50,0 g de carbonato de cálcio, obtém-se um resíduo A e um gás B.
Indique:
a) a equação representativa da calcinação e o volume do gás B nas CNTP;
b) a equação representativa da reação do resíduo com a água e a nomenclatura oficial (IUPAC) do produto dessa reação.
Questão 08. (Ufop MG/2006/2ªFase) Exercícios sobre Volume: O air bag, equipamento utilizado em veículos para aumentar a segurança de seus ocupantes em caso de colisão, é constituído por um saco plástico contendo substâncias químicas que reagem quando o automóvel sofre algum impacto, liberando gás nitrogênio e inflando o saco plástico. Em alguns automóveis, a reação envolvida no processo é:
![]()
Dados: Volume molar do gás a 1 atm e 25ºC igual a 24,5 litros.
Pede-se:
a) Os nomes das respectivas funções inorgânicas que aparecem na reação.
b) A equação balanceada.
c) Considerando-se a capacidade do air bag igual a 49 litros, calcular a massa de KNO3 necessária para que o mesmo seja inflado por completo, à temperatura de 25°C e pressão de 1 atm.
Questão 09. (Unesp SP/2006/Conh. Gerais) No início do século passado, foram desenvolvidas diversas armas químicas, dentre as quais o gás fosgênio. Sabe-se que 9,9 g deste gás ocupam 2,24 L, nas condições normais de temperatura e pressão, e que é constituído apenas por átomos de carbono, oxigênio e cloro.
Dadas as massas molares em g. mol–1: C = 12, O = 16 e Cl = 35,5
A fórmula mínima correta para este gás é:
a) C2OCl2.
b) C2OCl.
c) CO3Cl.
d) COCl2.
e) CO2Cl2.
Questão 10. (Ufms MS/2006/Exatas) Exercícios sobre Volume: Pentóxido de iodo, I2O5, é um reagente muito importante porque pode, na ausência de água, eliminar do ambiente o monóxido de carbono (CO), um dos principais poluentes da atmosfera urbana, conforme mostra a reação não-balanceada:
![]()
Considerando um rendimento de 100% para a reação acima, é correto afirmar que
01. são necessários 3,34×108g de I2O5 para eliminar 1,12×108L de CO do ar, nas CNTP.
02. o gás CO2 é tóxico tanto quanto o CO, porém é mais denso que ele.
04. o I2O5 é um composto covalente que age como um ácido de Brönsted nessa reação.
08. meio mol de I2O5 produz 56,0L de CO2(g), nas CNTP.
16. a reação acima é de redox, onde o CO é o redutor e o I2O5 é o oxidante.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado de química sobre Cálculos Estequimétricos com 10 Exercícios sobre Volume:
01: D;
02: E;
03: x = 1,62 x 1011 Litros;
04: B;
05: B;
06: C;
07:
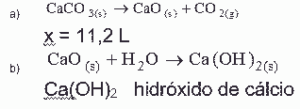
08:
a) Sal = KNO3
Óxidos = Na2O e K2O
b) ![]()
c)Xg = 404 de KNO3
09: D;
10: 025
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
