Questão 01 sobre Distribuição Eletrônica: (Uem PR/2008/Janeiro.) Quantos elétrons desemparelhados existem em um átomo que possui a configuração eletrônica 1s2 2s2 2p6 3s2 3p3?
a) 1 elétron
b) 2 elétrons
c) 3 elétrons
d) 4 elétrons
e) 5 elétrons
Questão 02. (Ufms MS/2008/Conh. Gerais) Uma grande fabricante mundial de brinquedos anunciou recentemente uma chamada aos clientes devido à necessidade de substituição de alguns de seus produtos (recall), com elevados teores de chumbo presentes no pigmento utilizado nas tintas aplicadas nesses brinquedos. O chumbo, na sua forma catiônica possui elevada toxicidade, afetando principalmente a síntese da hemoglobina nos organismos. Sabendo-se que o número atômico (Z) do chumbo é 82 e do xenônio é 54, assinale a alternativa que apresenta a configuração eletrônica correta para o cátion bivalente do chumbo.
a) [Xe] 6s2 4f14 5d10 6p2.
b) [Xe] 6s2 4f14 5d10.
c) [Xe] 4f14 5d9 6p1.
d) [Xe] 6s1 4f14 5d10 6p1.
e) [Xe] 6s2 4f14 5d8 6p2.
Questão 03. (Uem PR/2007/Julho) Assinale a alternativa correta.
a) A distribuição eletrônica do íon Ca2+ é 1s2 2s2 2p6 3s2 3p6 4s2.
b) A distribuição eletrônica do íon Mg2+ é 1s2 2s2 2p6 3s2 3p2.
c) A distribuição eletrônica do íon Ca2+ é igual à do íon Na+.
d) A distribuição eletrônica do íon Na+ é 1s2 2s2 2p4 3s2.
e) A distribuição eletrônica do íon Sr2+ é igual à do íon Rb+.
Questão 04 sobre Distribuição Eletrônica: (FFFCMPA RS/2007) Assinale a alternativa incorreta.
a) Pode-se dizer que um átomo ao perder um elétron se reduz.
b) É possível encontrar elétrons de mesmo spin num mesmo nível eletrônico.
c) Um elétron, quando recebe energia externa, salta para um nível eletrônico mais externo.
d) Um íon com número de oxidação +2 tem dois elétrons a menos em relação aos seus prótons.
e) Em um átomo é impossível encontrar dois elétrons com os quatro números quânticos iguais.
Questão 05. (Ufpr PR/2006) O modelo atômico de Bohr, apesar de ter sido considerado obsoleto em poucos anos, trouxe como principal contribuição o reconhecimento de que os elétrons ocupam diferentes níveis de energia nos átomos. O reconhecimento da existência de diferentes níveis na eletrosfera permitiu explicar, entre outros fenômenos, a periodicidade química. Modernamente, reconhece-se que cada nível, por sua vez, pode ser subdividido em diferentes subníveis.
Levando em consideração o exposto, assinale a alternativa correta.
a) O que caracteriza os elementos de números atômicos 25 a 28 é o preenchimento sucessivo de elétrons no mesmo nível e no mesmo subnível.
b) Os três níveis de mais baixa energia podem acomodar no máximo, respectivamente, 2, 8 e 8 elétrons.
c) O terceiro nível de energia é composto por quatro subníveis, denominados s, p, d e f.
d) O que caracteriza os elementos de números atômicos 11 a 14 é o preenchimento sucessivo de elétrons no mesmo nível e no mesmo subnível.
e) Os elementos de números atômicos 10, 18, 36 e 54 têm o elétron mais energético no mesmo nível, mas em diferentes subníveis.
Questão 06 sobre Distribuição Eletrônica: (Ufrn RN/2006) O oxigênio (O2) e o ozônio (O3) protegem a Terra da radiação ultravioleta, que, em excesso, é prejudicial aos seres vivos. As reações responsáveis por essa proteção são as seguintes:
(1) O2 + fótons ® 2O
(2) O3 + fótons ® O2 + O
O buraco na camada de ozônio vem aumentando devido, principalmente, ao alto nível de clorofluorcarbonos (CFCs) lançados na atmosfera pela ação do homem. Usando-se o Freon 12 (CCl2F2) como exemplo, o processo de consumo do O3 é mostrado abaixo:
(3) CCl2F2 + fótons ® CClF2 + Cl
(4) Cl + O3 ® ClO + O2
(5) ClO + O ® Cl + O2
A configuração eletrônica completa do elemento oxigênio e o número de elétrons presentes na sua camada de valência são, respectivamente,
a) 1s2 2s2 2p44 e 8 elétrons.
b) 1s2 2s2 2p4 e 6 elétrons.
c) 2s2 2p4 e 6 elétrons.
d) 2s2 2p4 e 8 elétrons.
Questão 07. (Unimontes MG/2006) O paramagnetismo – propriedade de ser atraído por um campo magnético – provém dos spins dos elétrons e ocorre em substâncias constituídas por íons ou átomos com elétrons desemparelhados.
Com base na configuração eletrônica dos cátions Ti4+, Fe2+, Al3+ e Cu+, pode ser atraído por um campo magnético o cátion
a) Ti4+.
b) Al3+.
c) Fe2+.
d) Cu+.
Questão 08. (Udesc SC/2006) Em uma aula de Química, o professor solicitou a seus alunos que representassem a carga iônica mais comum e a configuração eletrônica dos elementos químicos Li e Be.
O resultado foi o seguinte:
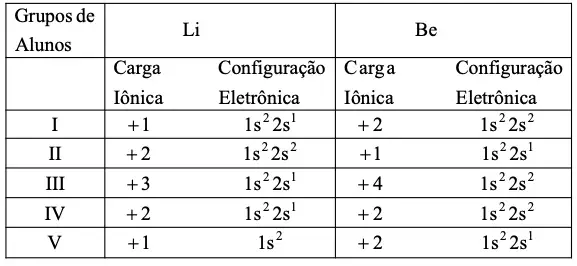
Assinale a alternativa correspondente ao grupo que resolveu corretamente o exercício solicitado.
a) Grupo V
b) Grupo I
c) Grupo III
d) Grupo IV
e) Grupo II
Questão 09. (Ufes ES/2005) A configuração eletrônica do átomo de ferro em ordem crescente de energia é 1s22s22p63s23p64s23d6. Na formação do íon Fe2+, o átomo neutro perde 2 elétrons. A configuração eletrônica do íon formado é :
a) 1s22s22p63s23p63d6
b) 1s22s22p63s23p64s23d4
c) 1s22s22p63s23p64s13d5
d) 1s22s22p63s23p44s13d6
e) 1s22s22p63s23p44s23d5
Questão 10 sobre Distribuição Eletrônica: (Uepb PB/2005) A representação gráfica abaixo mostra três níveis de energia de um determinado átomo:
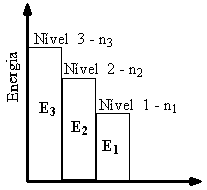
I. Um elétron precisa receber energia (E) correspondente a E2 – E1 para saltar do nível 1 para o nível 2.
II. O salto quântico referido acima (I) libera energia na forma de ondas eletromagnéticas.
III. O salto quântico n1 para n3 é menos energético que o salto n1 para n2.
Está(ão) correta(s) somente a(s) afirmativa(s)
a) III
b) II
c) I
d) I e II
e) I e III
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre Distribuição Eletrônica:
01. C
02. B
03. E
04. A
05. A
06. B
07. C
08. B
09. A
10. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
