Questão 01 sobre Propriedades da Tabela Periódica: (ITA-SP) Qual das alternativas a seguir apresenta a comparação ERRADA relativa aos raios de átomos e de íons?
A) Raio do Na+ < raio do Na
B) Raio do Na+ < raio do F–
C) Raio do Mg2+ < raio do O2–
D) Raio do F– < raio do O2–
E) Raio do F– < raio do Mg2+
Questão 02. (UFMG) Este gráfico apresenta as quatro primeiras energias de ionização de átomos de um metal pertencente ao terceiro período da tabela periódica:
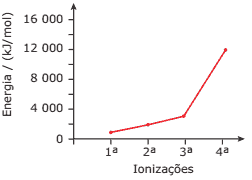
Isso porque, ao se retirar elétrons, a carga efetiva aumenta, aumentando a atração que o núcleo exerce sobre os elétrons restantes.
Com base nessas informações, é INCORRETO afirmar que os átomos desse metal apresentam:
A) raio atômico maior que o de qualquer dos não metais do mesmo período.
B) afinidade eletrônica menor que a de qualquer dos não metais do mesmo período.
C) 2 e 8 elétrons nos dois primeiros níveis de energia.
D) 4 elétrons no último nível de energia.
Questão 03 sobre Propriedades da Tabela Periódica: (UFOP-MG–2009) Um elemento M forma um íon M3+. O elemento M e o íon M3+ possuem:
A) o mesmo raio.
B) a mesma energia de ionização.
C) a mesma carga nuclear.
D) as mesmas propriedades químicas.
Questão 04. (UFV-MG) O raio atômico é uma propriedade periódica fundamental, pois tem implicações diretas sobre outras propriedades periódicas importantes, tais como energias de ionização e eletronegatividade. A figura a seguir ilustra a variação dos raios atômicos para os elementos representativos (excluídos os metais de transição).
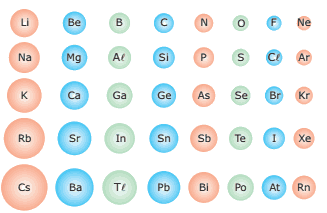
Analisando a figura anterior, assinale a afirmativa INCORRETA.
A) O elemento césio tem energia de ionização bem menor que o elemento flúor.
B) Os átomos de cloro perdem elétrons mais facilmente do que os de cálcio.
C) O oxigênio é mais eletronegativo que o alumínio.
D) As energias de ionização diminuem, nas colunas, com o aumento dos raios atômicos.
E) A eletronegatividade aumenta nos períodos com a diminuição dos raios atômicos.
Questão 05 sobre Propriedades da Tabela Periódica: (UFRGS) Considerando a posição dos elementos na tabela periódica e as tendências apresentadas por suas propriedades periódicas, pode-se afirmar que:
A) um átomo de halogênio do 4° período apresenta menor energia de ionização do que um átomo de calcogênio do mesmo período.
B) um metal alcalinoterroso do 3° período apresenta menor raio atômico do que um metal do 5° período e do mesmo grupo.
C) um átomo de gás nobre do 2° período tem maior raio atômico do que um átomo de gás nobre do 6° período.
D) um átomo de ametal do grupo 14 é mais eletronegativo do que um átomo de ametal do grupo 16, no mesmo período.
E) um átomo de metal do grupo 15 é mais eletropositivo do que um átomo de metal do grupo 1, no mesmo período.
Questão 06. (FCMMG–2009) Com relação às energias de ionização (EI) e aos raios (r) das espécies, a proposição INCORRETA é:
A) r(Na) > r(Na+).
B) r(Na+) > r(Mg2+).
C) 1ª EI(Na) > 1ª EI(Mg).
D) 1ª EI(Mg) < 2ª EI(Mg).
Questão 07 sobre Propriedades da Tabela Periódica: (UNIFESP–2009) O gráfico apresenta as primeiras e segundas energias de ionização (1 EI e 2 EI) para os elementos sódio, magnésio e cálcio, indicados como I, II e III, não necessariamente nessa ordem.
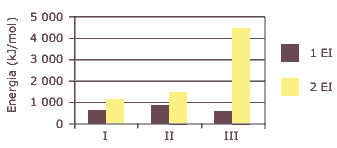
Entre esses elementos, aqueles que apresentam os maiores valores para a primeira e para a segunda energia de ionização são, respectivamente:
A) cálcio e magnésio.
B) cálcio e sódio.
C) magnésio e cálcio.
D) magnésio e sódio.
E) sódio e magnésio.
Questão 08. (UEL-PR) A tabela fornece dados sobre as quatro primeiras energias de ionização de quatro elementos químicos.
Energias de ionização (kJ.mol–1)
| Elemento | 1ª | 2ª | 3ª | 4ª |
| I | 496 | 4 536 | 6 913 | 9 541 |
| II | 738 | 1 450 | 7 731 | 10 545 |
| III | 418 | 3 069 | 4 600 | 5 879 |
| IV | 1 681 | 3 375 | 6 045 | 8 418 |
Dois desses elementos têm apenas um elétron de valência. São eles:
A) I e II.
B) I e III.
C) II e III.
D) II e IV.
E) III e IV.
Questão 09. (UFMG) As sucessivas energias de ionização do nitrogênio estão representadas no gráfico.
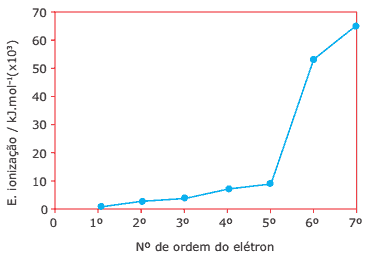
A) EXPLIQUE a variação observada nos valores de energia de ionização entre o primeiro e o quinto elétron.
B) EXPLIQUE por que o valor da energia de ionização do sexto elétron é muito maior do que a do quinto.
Dado: N (Z = 7).
Questão 10 sobre Propriedades da Tabela Periódica: (Unimontes-MG–2009) O raio atômico de quatro elementos, X, Y, W e Z, pertencentes a uma mesma família, é dado a seguir.
| Elementos | X | Y | W | Z |
| Raio atômico (nm) | 0,186 | 0,231 | 0,244 | 0,262 |
Esses elementos apresentam baixas energias de ionização e altos pontos de ebulição em relação aos outros elementos da tabela periódica. Baseando-se nessas informações, é INCORRETO afirmar que:
A) o elemento X tem o menor número de níveis energéticos em sua eletrosfera.
B) os elementos citados apresentam a mesma configuração eletrônica externa.
C) os elementos Y e W estão localizados em períodos diferentes da tabela.
D) o elemento Z apresenta a maior energia de ionização dos elementos citados.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de questões de química sobre Propriedades da Tabela Periódica:
01. E;
02. D;
03. C;
04. B;
05. B;
06. C;
07. D;
08. B;
09. A) As cinco primeiras energias de ionização do nitrogênio possuem valores próximos e crescentes. São próximos porque se referem a elétrons de um mesmo nível de energia e são crescentes devido ao aumento da carga nuclear efetiva a cada elétron arrancado.
B) A sexta energia de ionização do nitrogênio refere-se a um elétron de um nível menos energético em relação ao quinto elétron ionizado.
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
