Questão 01 sobre Relações Numéricas e Fundamentais da Química: (UFSC) A massa de um determinado átomo é 5/6 da massa do isótopo–12 do carbono. Qual é a sua massa atômica?
Questão 02. (Fasp) O elemento químico samário (Sm) foi encontrado pela primeira vez no minério conhecido por samarskita, derivado de Samarski, importante engenheiro russo. Se a massa atômica do samário é igual a 150, isso significa que seu átomo possui massa (x) vezes maior que (y). Escolha a alternativa que melhor completa a frase anterior.

Questão 03. (Unifor) Dos seguintes compostos, qual apresenta massa molecular igual a 30?
a) C2H6.
b) PH3.
c) NH3.
d) NO2.
e) N2O3.
Questão 04 sobre Relações Numéricas e Fundamentais da Química: (FECSL) A fórmula molecular de um certo sal é: X2(SO4)3 e sua massa molecular é igual a 342. Sabendo-se que as massas atômicas do oxigênio e do enxofre são, respectivamente, 16 e 32, pode-se afirmar que a massa atômica de X é igual a:
a) 15.
b) 27.
c) 30.
d) 45.
e) 54.
Questão 05. (UFF) Alguns óxidos de nitrogênio, dentre os quais N2O, NO, NO2, N2O3 e N2O5, podem ser detectados na emissão de gases produzidos por veículos e, também, por alguns processos para fabricação de fertilizantes. Tais óxidos contribuem para tornar o ar muito mais poluído nos grandes centros, tornando-o nocivo à saúde. Dentre os óxidos citados, o que apresenta maior percentual de N é:
a) NO.
b) NO2.
c) N2O.
d) N2O3.
e) N2O5.
Questão 06. (UERJ) Algumas substâncias, por fornecerem o nitrogênio indispensável à síntese de proteínas dos vegetais, têm grande aplicação em fertilizantes na agricultura. Analise as fórmulas de quatro dessas substâncias:
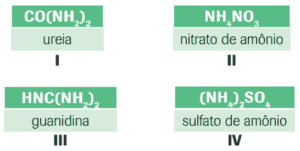
A substância que possui maior teor em massa de nitrogênio é a identificada pelo número:
a) I.
b) II.
c) III.
d) IV.
Questão 07 sobre Relações Numéricas e Fundamentais da Química: (FDB) A massa molecular da sulfanilamida (C6H8N2O2S) é:
a) 196u.
b) 174u.
c) 108u.
d) 112u.
e) 172u.
Questão 08. (Cesgranrio – adap.) A massa molecular do inseticida Parathion (C10H14O5NSP) é:
a) 53u.
b) 106u.
c) 152u.
d) 260u.
e) 291u.
Questão 09. (Vunesp) Na tabela periódica atual, a massa atômica de cada elemento aparece como um número não-inteiro porque:
a) há imprecisão nos métodos experimentais empregados.
b) é a média aritmética das massas atômicas dos elementos superior e inferior da mesma família.
c) é a média aritmética das massas atômicas dos elementos com igual número de prótons.
d) é a média ponderada das massas atômicas dos isótopos naturais do elemento.
e) é sempre múltipla da massa atômica do hidrogênio.
Questão 10 sobre Relações Numéricas e Fundamentais da Química: (Vunesp) O nitrato de amônio é utilizado em adubos como fonte de nitrogênio. A porcentagem em massa de nitrogênio no NH4NO3 é:
a) 35%.
b) 28%.
c) 17,5%.
d) 42,4%.
e) 21,2%.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre as Relações Numéricas e Fundamentais da Química:
01. 10u;
02. B;
03. A;
04. B;
05. C;
06. C;
07. E;
08. E;
09. D;
10. A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
