Questão 01 sobre Equilíbrio Iônico e Produto Iônico: (Unicamp) Vestibular, tempo de tensões, de alegrias, de surpresas… Naná e Chuá formam um casal de namorados. Eles estão prestando o Vestibular da Unicamp 2001. Já passaram pela primeira fase e agora se preparam para a etapa seguinte. Hoje resolveram rever a matéria de Química. Arrumaram o material sobre a mesa da sala e iniciaram o estudo:
— Será que estamos preparados para esta prova? –pergunta Naná.
— Acho que sim! – responde Chuá. – O fato de já sabermos que Química não se resume à regra de três e à decoração de fórmulas nos dá uma certa tranquilidade.
— Em grande parte graças à nossa professora – observa Naná.
— Bem, vamos ao estudo!
Naná responde prontamente; afinal a danada é craque em Química. Veja só o experimento e as perguntas que ela propõe a Chuá:
— Quando em solução aquosa, o cátion amônio, NH4 + dependendo do pH, pode originar cheiro de amônia, em intensidades diferentes. Imagine três tubos de ensaio, numerados de 1 a 3, contendo, cada um, porções iguais de uma mesma solução de NH4Cl. Adiciona-se, no tubo 1, uma dada quantidade de NaCH3COO e agita-se para que se dissolva totalmente. No tubo 2, coloca-se a mesma quantidade em moles de Na2CO3e também se agita até a dissolução. Da mesma forma se procede no tubo 3, com a adição de NaHCO3. A hidrólise dos ânions considerados pode ser representada pela seguinte equação:
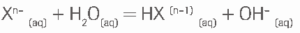
Os valores das constantes das bases Kb para acetato, carbonato e bicarbonato são, na sequência:
5,6 . 10-10, 5,6 . 10-4 e 2,4 . 10-8. A constante Kb da amônia é 1,8 . 10-5. (OBS: Os números após os sinais de – estão elevados).
a) Escreva a equação que representa a liberação de amônia a partir de uma solução aquosa que contém íons amônio.
b) Em qual dos tubos de ensaio se percebe cheiro mais forte de amônia? Justifique.
c) O pH da solução de cloreto de amônio é maior; menor ou igual a 7,0? Justifique usando equações químicas.
— Ô, Naná, você está querendo me estourar mas não vai conseguir. Lembro-me muito bem das explicações da nossa professora esclarecendo sobre equilíbrio em solução aquosa – fala Chuá.
Questão 02. (UFRJ) Existem indícios geológicos de que há, aproximadamente, 2 bilhões de anos, a atmosfera primitiva da Terra era constituída de cerca de 35% (em volume) de dióxido de carbono (gás carbônico), o que tornava improvável o surgimento de vida na superfície do planeta. Todavia, o aparecimento dos moluscos com conchas nos oceanos veio a colaborar significativamente para diminuir essa concentração.
a) Sabendo que as conchas dos moluscos são constituídas de carbonato de cálcio, escreva a equação global que representa as etapas reacionais de 1 a 4, relacionadas ao fenômeno acima.
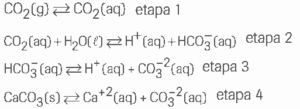
b) Explique como os moluscos com conchas participaram da diminuição da concentração do dióxido
de carbono na atmosfera.
Questão 03. (UFF) Uma solução de ácido acético 0,050M apresenta um grau de dissociação (α) 0,4% à temperatura de 25°C. Para essa solução, à temperatura mencionada, calcule:
a) o valor da constante de equilíbrio.
b) a concentração do íon acetato.
c) o pH da solução.
d) a concentração de todas as espécies em solução.
Dado: log 2 = 0,301.
Questão 04 sobre Equilíbrio Iônico e Produto Iônico: (UFRJ) O vinhoto é um resíduo aquoso subproduto do processo de produção de álcool a partir do licor de fermentação da cana-de-açúcar. Rico em potássio e fósforo, mas pobre em nitrogênio, o vinhoto vem sendo utilizado como fertilizante em plantações de cana-de-açúcar. Para tornar o vinhoto um fertilizante melhor, propõe-se diminuir a sua acidez e acrescentar nitrogênio.
a) Das seguintes substâncias (NaOH, NH4OH, NH4NO3 e NaCl), escolha aquela a ser adicionada à solução de vinhoto para torná-la um melhor fertilizante. Justifique.
b) Sabendo que o vinhoto é ácido, explique por que a solubilidade da amônia em vinhoto é maior do que em água pura.
Questão 05. (Unesp) A maior parte do dióxido de carbono gerado no metabolismo celular, no corpo humano, por reagir rapidamente com a água contida no sangue, é conduzida pela corrente sanguínea, para eliminação nos pulmões.
a) Escreva a equação química que representa a reação de equilíbrio entre o dióxido de carbono e a água.
b) Se no sangue não houvesse outras substâncias que garantissem um pH próximo de 7, qual seria a consequência da reação do gás carbônico com a água do sangue, em termos de pH?
Questão 06. (UFJF) A amônia anidra é um gás incolor de odor intenso. Quando dissolvida em água, recebe o nome de hidróxido de amônio.
a) Calcule o pH da solução de hidróxido de amônio 0,05molxL-1, nas condições ambientes.
b) Considere, em seu cálculo, o valor da constante de ionização da amônia igual a 2,0 . 10-5 e despreze a autoionização da água.
c) Escreva o nome da forma geométrica da molécula da amônia e classifique o tipo de ligação interatômica nela presente, a partir da diferença de eletronegatividade.
Questão 07 sobre Equilíbrio Iônico e Produto Iônico: (UFJF) O esmalte do dente é constituído por um material muito pouco solúvel em água e cujo principal componente é a hidroxiapatita, Ca5(PO4)3OH. Quando o ser humano atinge a fase adulta, pode ocorrer tanto o processo de desmineralização quanto o de mineralização dos dentes. A equação a seguir representa os processos mencionados em equilíbrio:
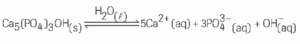
Baseando-se nas informações acima, indique qual das espécies adiante promoveria a deterioração do dente:
a) Ca(OH)
b) OH–
c) H +
d) KOH
e) Ca3(PO4)2
Questão 08. (UFRRJ) Para descolar o equilíbrio ![]() , a fim de se produzir dicromato:
, a fim de se produzir dicromato:
a) acrescenta-se base, ficando com [H3O+] > 10-7
b) acrescenta-se ácido, ficando com [H3O+] > 10-7
c) retira-se ácido, ficando com [H3O+] < 10-7
d) adiciona-se base, ficando com [H3O+] < 10-7
e) adiciona-se ácido, ficando com [H3O+] = 10-7
Questão 09. (ITA) Numa solução aquosa 0,100mol/L de um ácido monocarboxílico, a 25ºC, o ácido está a 3,7% dissociado após o equilíbrio ter sido atingido. Indique a opção que contém o valor correto da constante de dissociação desse ácido nessa temperatura.
a) 1,4
b) 1,4 . 10-3
c) 1,4 . 10-4
d) 3,7 . 10-2
e) 3,7 . 10-4
Questão 10 sobre Equilíbrio Iônico e Produto Iônico: A seguir estão tabeladas as constantes de ionização (Ka) em solução aquosa a 25ºC.
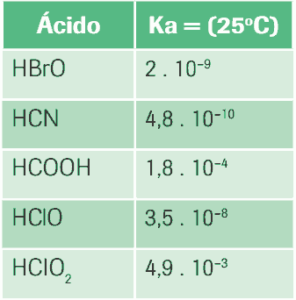
Indique sua ordem crescente de acidez.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre Equilíbrio Iônico e Produto Iônico:
01.
a) Observe as equações a seguir:
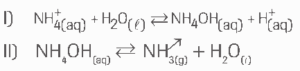
b) Percebe-se cheiro mais forte de amônia no tubo 2.
A adição de Na2CO3 torna o meio mais básico (maior Kb), o que provoca maior consumo de H+, deslocando o equilíbrio I para a direita e favorecendo a formação de NH4OH(aq), que por sua vez se decompõe produzindo mais amônia (NH3).
c) O cloreto de amônio é um sal de caráter ácido, pois é proveniente de um ácido forte (HCl) e uma base fraca (NH4OH).
Logo a sua hidrólise salina origina uma solução ácida (pH<7):

02.
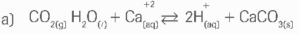
b) Com a formação de carbonato de cálcio o equilíbrio da reação do item a é deslocado para a direita, implicando na diminuição da concentração de dióxido de carbono atmosférico, CO2(g).
03.

04.
a) O NH4OH, pois das substâncias relacionadas apenas ela e o NaOH são básicas e podem portanto diminuir a acidez, e das duas, só o NH4OH contém nitrogênio.
b) Ao solubilizar-se em água, a amônia reage com esta, formando o cátion amônio e o ânion hidroxila, em um equilíbrio ácido-base (equação 1). Com o aumento da concentração de H+, caso do vinhoto, a hidroxila é protonada (equação 2), deslocando o equilíbrio da equação 1 no sentido da formação do produto, ou seja, de consumo de mais amônia quando comparado com a água pura.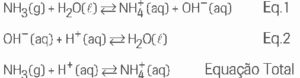
05.
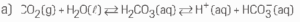
b) O sangue se tornaria ácido (pH < 7).
06.
a) 11
b) Geometria piramidal.
c) Ligação covalente.
07. C;
08. B;
09. C
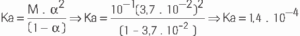
10. HCN < HBrO < HClO < HCOOH < HClO2
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
