Questão 01. (ITA-SP–2006) Questões de calorimetria: Um bloco de gelo com 725 g de massa é colocado num calorímetro contendo 2,50 kg de água a uma temperatura de 5,0 ºC, verificando-se um aumento de 64 g na massa desse bloco, uma vez alcançado o equilíbrio térmico. Considere o calor específico da água (c = 1,0 cal/g ºC) o dobro do calor específico do gelo, e o calor latente de fusão do gelo de 80 cal/g.
Desconsiderando a capacidade térmica do calorímetro e a troca de calor com o exterior, assinale a temperatura inicial do gelo.
A) –191,4 ºC
B) –48,6 ºC
C) –34,5 ºC
D) –24,3 ºC
E) –14,1 ºC
Questão 02. (Enem–2009) A Constelação Vulpécula (Raposa) encontra-se a 63 anos-luz da Terra, fora do sistema solar. Ali, o planeta gigante HD 189733b, 15% maior que Júpiter, concentra vapor de água na atmosfera. A temperatura do vapor atinge 900 graus Celsius. “A água sempre está lá, de alguma forma, mas às vezes é possível que seja escondida por outros tipos de nuvens”, afirmaram os astrônomos do Spitzer Science Center (SSC), com sede em Pasadena, Califórnia, responsável pela descoberta. A água foi detectada pelo espectrógrafo infravermelho, um aparelho do telescópio espacial Spitzer.
CORREIO BRAZILIENSE, 11 dez. 2008 (Adaptação).
De acordo com o texto, o planeta concentra vapor de água em sua atmosfera a 900 graus Celsius. Sobre a vaporização, infere-se que:
A) se há vapor de água no planeta, é certo que existe água no estado líquido também.
B) a temperatura de ebulição da água independe da pressão, em um local elevado ou ao nível do mar, ela ferve sempre a 100 graus Celsius.
C) o calor de vaporização da água é o calor necessário para fazer 1 kg de água líquida se transformar em 1 kg de vapor de água a 100 graus Celsius.
D) um líquido pode ser superaquecido acima de sua temperatura de ebulição normal, mas de forma nenhuma nesse líquido haverá formação de bolhas.
E) a água em uma panela pode atingir a temperatura de ebulição em alguns minutos, e é necessário muito menos tempo para fazer a água vaporizar completamente.
Questão 03. (UFJF-MG–2006) Um bloco de chumbo de 6,68 kg é retirado de um forno a 300 °C e colocado sobre um grande bloco de gelo a 0 °C. Supondo que não haja perda de calor para o meio externo, qual é a quantidade de gelo que deve ser fundida?
Dados:
• calor específico do gelo a 0 °C = 2 100 J/(kg.K)
• calor latente de fusão do gelo = 334 x 103 J/kg
• calor específico do chumbo = 230 J/(kg.K)
• calor latente de fusão do chumbo = 24,5 x 103 J/kg
• temperatura de fusão do chumbo = 327 °C
Questão 04. (UFMG) Questões de calorimetria: Colocando-se uma esfera de ferro de massa 100 g na cavidade de um bloco de gelo a 0 °C, observa-se a fusão de 30 g de gelo, quando a temperatura da esfera passa de 200 ºC para a do gelo. CALCULE o calor específico do ferro, sabendo-se que são necessárias 80 calorias para fundir 1 grama de gelo.
Questão 05. (Enem–2009) O Sol representa uma fonte limpa e inesgotável de energia para o nosso planeta. Essa energia pode ser captada por aquecedores solares, armazenada e convertida posteriormente em trabalho útil. Considere determinada região cuja insolação – potência solar incidente na superfície da Terra – seja de 800 watts/m2. Uma usina termossolar utiliza concentradores solares parabólicos que chegam a dezenas de quilômetros de extensão. Nesses coletores solares parabólicos, a luz refletida pela superfície parabólica espelhada é focalizada em um receptor em forma de cano e aquece o óleo contido em seu interior a 400 °C. O calor desse óleo é transferido para a água, vaporizando-a em uma caldeira. O vapor em alta pressão movimenta uma turbina acoplada a um gerador de energia elétrica.
Considerando que a distância entre a borda inferior e a borda superior da superfície refletora tenha 6 m de largura e que focaliza no receptor os 800 watts/m2 de radiação provenientes do Sol, e que o calor específico da água é 1 cal g–1.ºC-1 = 4 200 J kg-1 ºC-1, então o comprimento linear do refletor parabólico necessário para elevar a temperatura de 1 m3 (equivalente a 1 t) de água de 20 °C para 100 °C, em uma hora, estará entre:
A) 15 m e 21 m.
B) 22 m e 30 m.
C) 105 m e 125 m.
D) 680 m e 710 m.
E) 6 700 m e 7 150 m.
Questão 06. (Enem–1999) A panela de pressão permite que os alimentos sejam cozidos em água muito mais rapidamente do que em panelas convencionais. Sua tampa possui uma borracha de vedação que não deixa o vapor escapar, a não ser através de um orifício central sobre o qual assenta um peso que controla a pressão. Quando em uso, desenvolve-se uma pressão elevada no seu interior. Para a sua operação segura, é necessário observar a limpeza do orifício central e a existência de uma válvula de segurança, normalmente situada na tampa. O esquema da panela de pressão e um diagrama de fase da água são apresentados a seguir.
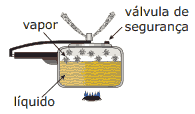
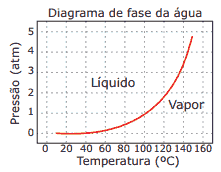
A vantagem do uso de panela de pressão é a rapidez para o cozimento de alimentos e isto se deve:
A) à pressão no seu interior, que é igual à pressão externa.
B) à temperatura de seu interior, que está acima da temperatura de ebulição da água no local.
C) à quantidade de calor adicional que é transferida à panela.
D) à quantidade de vapor que está sendo liberada pela válvula.
E) à espessura da sua parede, que é maior que a das panelas comuns.
Questão 07. (UERJ–2010) Questões de calorimetria: A tabela a seguir mostra apenas alguns valores, omitindo outros, para três grandezas associadas a cinco diferentes objetos sólidos:
• massa;
• calor específico;
• energia recebida ao sofrer um aumento de temperatura de 10 ºC.
| Objetos | m (g) | c (cal·g–1·ºC–1) | Q (cal) |
| I | 0,3 | 300 | |
| II | 0,2 | 400 | |
| III | 150 | 450 | |
| IV | 150 | 0,4 | |
| V | 100 | 0,5 |
A alternativa que indica, respectivamente, o objeto de maior massa, o de maior calor específico e o que recebeu maior quantidade de calor é:
A) I, III e IV
B) I, II e IV
C) II, IV e V
D) II, V e IV
Questão 08. (UFMG–2009) Num laboratório de Física, faz-se uma experiência com dois objetos de materiais diferentes – R e S –, mas de mesma massa, ambos, inicialmente, no estado sólido e à temperatura ambiente. Em seguida, os dois objetos são aquecidos e, então, mede-se a temperatura de cada um deles em função da quantidade de calor que lhes é fornecida. Os resultados obtidos nessa medição estão representados neste gráfico:
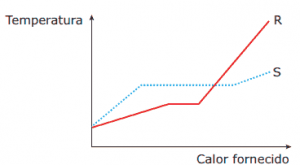
Sejam LR e LS o calor latente de fusão dos materiais R e S, respectivamente, e cR e cS o calor específico dos materiais, no estado sólido, também respectivamente.
Considerando-se essas informações, é CORRETO afirmar que:
A) cR < cS e LR < LS.
B) cR < cS e LR > LS.
C) cR > cS e LR < LS.
D) cR > cS e LR > LS.
Questão 09. (FUVEST-SP) Questões de calorimetria: O gráfico representa a variação, com o tempo, da temperatura de um sistema constituído de um pedaço de gelo de 500 g a –10 ºC.
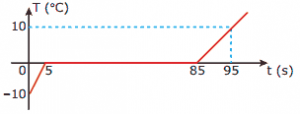
A) DESCREVA o estado físico do sistema entre os instantes 5 s e 85 s.
B) Se o calor específico do gelo é de 0,50 cal/g°C, CALCULE a quantidade de calor absorvida pelo gelo entre os instantes 0 e 5 s.

Gabarito com as respostas das Questões de Calorimetria para Ensino Médio e Superior.
01. B;
02. C;
03. m = 1,38 kg;
04. c = 0,12 cal/g.°C;
05. A;
06. B;
07. D;
08. C;
09. A) sólido + líquido, ocorrendo fusão
B) 2 500 cal
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
