Questão 01 sobre Velocidade e Fatores da Reação: (PUC Minas) Considere a equação:
2NO2(g) + 4CO(g) → N2(g) + 4CO2(g)
Admita que a formação do N2(g) tem uma velocidade média constante igual a 0,05 mol.min-1. A massa de CO2(g), em gramas, formada em 1 hora, é:
A) 8,8.
B) 44,0.
C) 84,0.
D) 132,0.
E) 528,0.
Questão 02. (Cesgranrio) O gráfico representa a variação das concentrações das substâncias X, Y e Z durante a reação em que elas tomam parte:
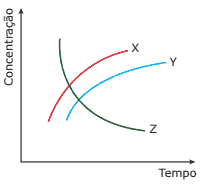
A equação que representa a reação é
A) X + Z → Y.
B) X + Y → Z.
C) X → Y + Z.
D) Y → X + Z.
E) Z → X + Y.
Questão 03 sobre Velocidade e Fatores da Reação: O air bag, dispositivo de segurança utilizado em alguns veículos, é inflado, em caso de acidente, com gás N2 produzido pela reação:
2NaN3(s) → 2Na(s) + 3N2(g)
O tempo necessário para que um air bag seja completamente inflado, atingindo um volume de 54 L, é de 1/20 s. CALCULE a velocidade de formação do N2 em litros por segundo e a velocidade de consumo do NaN3 em mol por segundo. Dado: Volume molar na temperatura ambiente: 27 L.
Questão 04. Em determinada experiência, a reação de formação de água está ocorrendo com o consumo de quatro mols de oxigênio por minuto. Consequentemente, a velocidade de consumo de hidrogênio é de:
A) 2 mol.min-1.
B) 4 mol.min-1.
C) 8 mol.min-1.
D) 12 mol.min-1.
E) 16 mol.min-1.
Questão 05 sobre Velocidade e Fatores da Reação: (PUC Minas) A poluição pelo NO2(g) é uma das causas da destruição da camada de ozônio. Uma das reações que pode ocorrer no ar poluído é a reação do dióxido de nitrogênio com o ozônio:
2NO2(g) + O3(g) → N2O5(g) + O2(g)
Admita que a formação do O2(g) tem uma rapidez média constante igual a 0,05 mol.L-1.s-1. A massa de O3(g) consumida em 1 min, é, em gramas:
A) 2,40.
B) 144,00.
C) 1,60.
D) 96,00.
E) 48,00.
Questão 06. (UFSCar-SP) Com relação à reação:
2A + 3B → 2C + D
Podemos afirmar que:
A) os reagentes (A e B) são consumidos com a mesma velocidade.
B) a velocidade de desaparecimento de A é igual à velocidade de aparecimento de C.
C) os produtos (C e D) são formados com a mesma velocidade.
D) a velocidade de aparecimento de D é três (3) vezes maior que a velocidade de desaparecimento de B.
E) a velocidade de desaparecimento de A é a metade da velocidade de aparecimento de D.
Questão 07 sobre Velocidade e Fatores da Reação: (UFSC) Para a reação A + 2B → C, com as concentrações iniciais de A e B iguais a 8,5 mol.L-1 e 15 mol.L-1, respectivamente, colheram-se os seguintes dados em laboratório:
| Tempo (h) | [C] |
| 0,0 | 0,0 |
| 1,0 | 3,0 |
| 2,0 | 4,5 |
| 3,0 | 5,0 |
| 4,0 | 5,5 |
Em que [C] é a concentração molar de C. Com os dados fornecidos, CALCULE:
A) a velocidade média da reação no intervalo de 1h a 3h.
B) a concentração de A no tempo de 4h.
Questão 08. (PUC-Campinas-SP) A combustão do butano corresponde à equação:
C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(l)
Se a velocidade da reação for 0,05 mol de butano por minuto, DETERMINE a massa de CO2 produzida em meia hora.
Questão 09. (UFMG) A água oxigenada, H2O2, decompõe-se para formar água e oxigênio, de acordo com a equação:
H2O2(l) → H2O(l) + 12O2(g)
A rapidez dessa reação pode ser determinada recolhendo-se o gás em um sistema fechado, de volume constante, e medindo-se a pressão do oxigênio formado em função do tempo de reação.
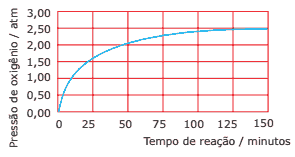
Em uma determinada experiência, realizada a 25 ºC, foram encontrados os resultados mostrados no gráfico. Considerando-se o gráfico, pode-se afirmar que a rapidez de decomposição da água oxigenada:
A) aumenta durante o processo de decomposição.
B) tende para zero no final do processo de decomposição.
C) é constante durante todo o processo de decomposição.
D) é igual a zero no início do processo de decomposição.
Questão 10 sobre Velocidade e Fatores da Reação: (FCMMG–2009) Na reação de zinco metálico com excesso de ácido clorídrico, são formados um sal e hidrogênio molecular. O gráfico que melhor representa a variação do volume do gás obtido com o tempo, desde o início da reação (tempo zero) até o seu fim, é:
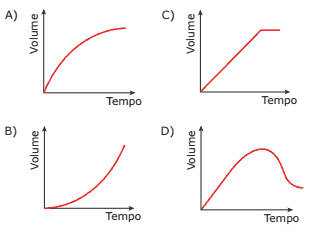
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das atividades sobre Velocidade e Fatores da Reação:
01. E;
02. E;
03. vf (N2(g)) = 1 080 L.s–1
vc (NaN3(s)) = 26,67 mol.s–1
04. C;
05. B;
06. B;
07. A) 1 mol.L–1.h–1
B) 3 mol.L–1
08. 264 g de CO2(g) em 30 min.
09. B;
10. A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
