Questão 01 sobre Pureza Química: (Unifesp SP/2006/2ªFase. Existem diferentes formas pelas quais a água pode fazer parte da composição dos sólidos, resultando numa grande variedade de substâncias encontradas na natureza que contêm água ou elementos que a formam. A água de estrutura é denominada de água de hidratação, que difere muito da água de absorção ou adsorção. A água de constituição é uma forma de água em sólidos, que é formada quando estes se decompõem pela ação de calor.
a) O NaHCO3 e Ca(OH)2 são sólidos que apresentam água de constituição. Escreva as equações, devidamente balanceadas, que evidenciam essa afirmação, sabendo-se que na decomposição do bicarbonato de sódio é produzido um óxido de caráter ácido.
b) No tratamento pós-operatório, um medicamento usado para estimular a cicatrização é o sulfato de zinco hidratado, ![]() . A análise desse sólido indicou 43,9% em massa de água. Determine neste composto o número de moléculas de água por fórmula unitária.
. A análise desse sólido indicou 43,9% em massa de água. Determine neste composto o número de moléculas de água por fórmula unitária.
Dadas massas molares (g/mol): ZnSO4 = 161,5 e H2O = 18,0.
Questão 02. (Ufop MG/2006/2ªFase)
Comercialmente, a pureza de um objeto de ouro é indicada em quilates, sendo que 1 quilate corresponde a 1/24 da massa do objeto em ouro. O ouro pode ser solubilizado em uma mistura ácida, denominada de água régia, conforme a seguinte equação não-balanceada:
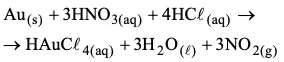
a) Determine o número de átomos de ouro contidos em uma aliança de 2,63 g, sendo que o teor de ouro é de 18 quilates.
b) Determine o volume de NO2(g) produzido na CNTP quando a massa de ouro contida na aliança, referida no item anterior, é dissolvida em água régia.
Questão 03 sobre Pureza Química: (Ufms MS/2006/Exatas. Uma forma de se determinar íons chumbo numa amostra consiste na precipitação dos íons chumbo em solução homogênea (PSH), na qual os íons crômio VI são gerados no meio reacional de forma uniforme e lenta. O processo ocorre de acordo com a seguinte equação não-balanceada:

Uma amostra de 5,0g de uma liga metálica contendo chumbo foi solubilizada em 250mL de solução.
Uma alíquota de 25mL dessa solução foi devidamente tratada com excesso de solução precipitante, tendo-se obtido, ao final do processo, 0,2341g de cromato de chumbo. Calcule o teor de chumbo II, em percentual, nessa amostra. Dados: massas (gmol–1): Cr=52, Pb=207, O=16
Questão 04. (Ufpe PE/2006) Uma amostra mineral contendo magnetita (Fe3O4) foi analisada dissolvendo-se 0,928g de amostra em HCl concentrado. Obteve-se uma mistura contendo íons ferro nos estados de oxidação II e III. A esta solução, adicionou-se HNO3 suficiente para oxidar todo o Fe2+ a Fe3+, que foi, em seguida, precipitado como Fe(OH)3 pela adição de NH3. O hidróxido de ferro III foi, então, submetido a um tratamento térmico que originou 0,480g de Fe2O3 puro. Qual é a porcentagem em massa de magnetita na amostra? (Dados: massas molares em g mol–1: Fe = 56; O = 16; H = 1; N = 14)
a) 50%
b) 60%
c) 55%
d) 25%
e) 75%
Questão 05. (Fepcs DF/2006. O azoteto de chumbo, Pb(N3)2, é um explosivo facilmente detonável que libera um grande volume de nitrogênio gasoso quando golpeado. Sua decomposição produz chumbo e gás nitrogênio.
Partindo-se de 7,76 g de azoteto de chumbo contendo 25% de impurezas, o volume de nitrogênio recolhido nas condições ambientes é:
(Dado: volume molar nas condições ambientes = 24 L)
a) 0,48 L;
b) 1,08 L;
c) 2,4 L;
d) 1,44 L;
e) 24 L.
Questão 06 sobre Pureza Química: (Uepb PB/2006) Um caminhão tanque carregando 9,8×103 kg de ácido sulfúrico concentrado tomba e derrama sua carga. Se a solução é 95% de H2SO4 em massa, quantos quilogramas de carbonato de cálcio (CaCO3) são necessários para neutralizar o ácido?
a) 9800 kg
b) 9500 kg
c) 10000 kg
d) 9120 kg
e) 10500 kg
Questão 07. (IME RJ/2006. O gás obtido pela completa decomposição térmica de uma amostra de carbonato de cálcio com 50,0% de pureza é recolhido em um recipiente de 300 mL a 27,0ºC. Sabendo-se que a pressão no recipiente é de 1,66 MPa, determine:
a) a massa de gás produzido, admitindo que seu comportamento seja ideal;
b) a massa da amostra utilizada.
Questão 08. (Udesc SC/2006). O dióxido de enxofre (SO2) é produzido como um sub-produto da queima de combustíveis fósseis. Ele pode combinar-se diretamente com água, formando o ácido sulfuroso (H2SO3) ou, na presença de poeira e aerossóis, pode reagir com oxigênio atmosférico, para formar trióxido de enxofre (SO3), que produz ácido sulfúrico (H2SO4) em água. Este, um ácido forte, é um dos componentes da “chuva ácida”, que causa uma série de danos ao meio ambiente.
Com base nessas informações, responda:
a) Em uma termoelétrica, qual é a massa de SO2 produzida pela queima de uma tonelada de carvão mineral contendo 2,5% de enxofre?
b) O SO2 pode ser removido das emissões gasosas de termoelétricas pela reação com calcário:
2 SO2 (g) + 2 CaCO3 (s) + O2 (g) ![]() 2 CaSO4 (s) + 2 CO2 (g)
2 CaSO4 (s) + 2 CO2 (g)
Qual a massa de calcário necessária para remover o SO2 produzido no item (a), se o processo tem 90% de rendimento?
Dados: Massas atômicas relativas: C = 12; O = 16; S = 32; Ca = 40.
Considere o O2 em excesso para ambos os itens.
Questão 09. (Uni-Rio RJ/2006) A polícia indonésia encontrou nesta terça-feira uma bomba na estação de trem Tanjung Barat, ao sul da capital Jacarta. Os policiais conseguiram desarmar o artefato explosivo, que tinha 300 gramas de sulfato de potássio.”
O Globo, 2005.
O sulfato de potássio pode ser formado através da reação:
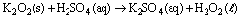
Calcule o grau de pureza do ácido sulfúrico quando 75,0 mililitros reagem com peróxido de potássio suficiente para produzirem a massa de sulfato de potássio indicada no texto. Considere a densidade do ácido sulfúrico igual a 1,8 g/cm3.
Questão 10 sobre Pureza Química: (Ufes ES/2005). Uma amostra de calcário dolomítico, contendo 60% de carbonato de cálcio e 21% de carbonato de magnésio, sofre decomposição quando submetida a aquecimento, segundo a equação abaixo: CaCO3(s) + MgCO3(s) ® CaO(s) + MgO(s) + 2CO2(g)
A massa de óxido de cálcio e a massa de óxido de magnésio, em gramas, obtidas com a queima de 1 quilo de calcário são, respectivamente,
Dados: Ca = 40; C =12; O = 16; Mg =24.
a) 60 ; 21
b) 100 ; 84
c) 184 ; 96
d) 336 ; 100
e) 600 ; 210
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões sobre Pureza Química:
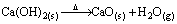
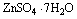
02. a) Y= 6,02×1021 átomos de ouro
b) X = 0,67 litros de NO2
03. 030
04. A
05. D
06. B
07. a) 8,78g CO2
b) 39,90g da amostra
08. a) 50kg
b) 70,31kg
09. 79,9%
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
