Questão 01 sobre Processos Eletroquímicos: (Fatec-SP–2010) Considere os seguintes dados sobre potenciais padrão de redução.
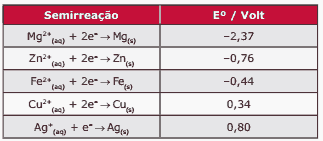
Uma tubulação de ferro pode ser protegida contra a corrosão se a ela for conectada uma peça metálica constituída de:
A) magnésio ou prata.
B) magnésio ou zinco.
C) zinco ou cobre.
D) zinco ou prata.
E) cobre ou prata.
Questão 02. (Unimontes-MG–2007) Lâminas metálicas foram introduzidas, sucessivamente, em soluções contendo cátions de outros metais, observando-se, em alguns casos, depósito do metal (+) ou não (–), como mostram os resultados apresentados a seguir:
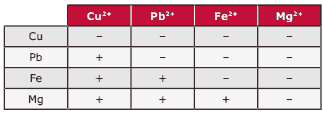
A facilidade com que lâminas metálicas cedem elétrons quando imersas em certas soluções, ou, também, a facilidade com que íons positivos recebem elétrons são expressas através do potencial de eletrodo (Eº). Assim, o metal com MAIOR potencial de oxidação é o:
A) Fe.
B) Pb.
C) Mg.
D) Cu.
Questão 03 sobre Processos Eletroquímicos: (UFG–2009 / Adaptado) A corrosão de dutos é um sério problema na exploração do petróleo no mar. Uma alternativa simples para evitá-la é ligar os dutos a um metal de sacrifício. Considerando que os dutos utilizados em uma plataforma de exploração sejam de ferro, qual deve ser o metal MAIS eficiente para evitar a corrosão?

A) Alumínio
B) Berílio
C) Chumbo
D) Ouro
E) Prata
Questão 04. (UFMG) Os metais possuem diferentes tendências de sofrer corrosão, um processo natural de oxidação. A corrosão pode ser relacionada com a facilidade de se obter os metais a partir de seus minérios. Essas informações estão representadas no diagrama, para alguns metais.

Com relação ao exposto, assinale a afirmativa FALSA.
A) A maior facilidade de um metal sofrer corrosão corresponde a uma maior dificuldade para obtê-lo a partir de seu minério.
B) A prata, a platina e o ouro são considerados metais nobres pela sua dificuldade de oxidar-se.
C) Os metais com maior facilidade de oxidação são encontrados na natureza na forma de substâncias simples.
D) O zinco metálico é o mais reativo entre os metais listados.
Questão 05 sobre Processos Eletroquímicos: (UFJF-MG) Usando os dados fornecidos:

responda: O agente redutor MAIS forte entre as substâncias da tabela é
A) K.
B) Zn.
C) Pb.
D) Cu.
E) Ag.
Questão 06. (UFJF-MG) Mergulha-se uma lâmina metálica de níquel limpa em uma solução de sulfato de cobre, cuja coloração é azul. Com o passar de algum tempo, observa-se que a lâmina torna-se recoberta por um material avermelhado e que a solução torna-se verde, devido à formação de íons Ni2+.
Sobre o processo descrito anteriormente, pode-se afirmar que:
A) a concentração de íons sulfato diminui durante o processo.
B) o íon cobre é um agente redutor.
C) o íon cobre cede elétrons à placa de níquel.
D) um íon cobre é reduzido para cada dois átomos de níquel oxidado.
E) o níquel metálico é oxidado na presença dos íons cobre.
Questão 07 sobre Processos Eletroquímicos: (UFMG) Lâminas metálicas de chumbo, Pb, e zinco, Zn, foram introduzidas em soluções aquosas de Cu(NO3)2, conforme mostrado nestas duas figuras:

Observou-se que o cobre metálico se deposita sobre as placas nos dois recipientes. Considerando-se esses experimentos, é INCORRETO afirmar que:
A) o íon Cu2+ é oxidado pelo zinco metálico.
B) o chumbo metálico é oxidado pelo íon Cu2+.
C) o íon Cu2+ atua como agente oxidante quando em contato com a lâmina de zinco.
D) o zinco metálico atua como agente redutor quando em contato com a solução de Cu2+.
Questão 08. (Fatec-SP–2008) Considere os seguintes dados sobre potenciais padrão de eletrodo:

Se uma lâmina de cobre puro for mergulhada em uma solução ácida de cloreto de ferro (III), a 1 mol.L–1, nas condições padrão, haverá, em um primeiro momento:
A) dissolução do cobre da lâmina.
B) formação de cloro gasoso.
C) liberação de hidrogênio gasoso.
D) depósito de ferro metálico.
E) formação de mais íons cloreto.
Questão 09. (UEL-PR) Considere a tabela de potencial padrão de redução a seguir:
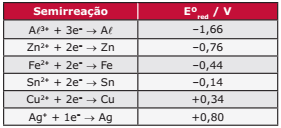
Os cascos de navios, normalmente feitos de ferro, são protegidos da corrosão mediante a colocação de metais de sacrifício, ou seja, metais que sofrem preferencialmente a corrosão.
Com base no exposto anteriormente, é CORRETO afirmar:
A) A corrosão ocorre porque o oxigênio é oxidado e o ferro se transforma em Fe(OH)3.
B) O metal de sacrifício deve ter um potencial padrão de redução menor que o do metal que se deseja proteger.
C) O metal de sacrifício deve ser um redutor mais fraco que o ferro.
D) O metal de sacrifício atua doando elétrons como se fosse o cátodo de uma pilha.
E) Da tabela, pode-se concluir que o melhor metal de sacrifício é a prata.
Questão 10 sobre Processos Eletroquímicos: (Enem) Uma das atividades humanas mais antigas é a metalurgia, que consiste em obter diferentes metais a partir de seus minérios. Na natureza, a maioria dos metais aparece na forma de substâncias compostas. Para avaliar a reatividade química de cátions metálicos ou metais, podemos comparar seus potenciais padrões de redução. Metais muito reativos têm cátions muito estáveis, e, por isso, a obtenção de tais metais a partir dos minérios é difícil e cara. Já os metais de menor reatividade química têm cátions pouco estáveis, o que torna mais fácil a obtenção destes a partir de seus minérios.
A seguir, são informados alguns potenciais padrão de redução:

Entre os metais apresentados na tabela, aquele que reage de forma mais vigorosa com uma solução diluída de ácido clorídrico (HCl) e que, também, é o mais difícil de ser produzido a partir de seus minérios é o:
A) cobre.
B) ferro.
C) magnésio.
D) níquel.
E) zinco.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de Química sobre Processos Eletroquímicos:
01. B;
02. C;
03. B;
04. C;
05. A;
06. E;
07. A;
08. A;
09. B;
10. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
