Questão 01 sobre Ácidos: (Ufg GO/2000/1ªFase). A vida aquática só é possível, devido à solubilidade de vários gases na água. Borbulhando, na água,
01. o gás hidrogênio, forma-se o íon H3O+.
02. o SO2 , o meio torna-se condutor de corrente elétrica.
03. o ácido clorídrico, ocorre reação química.
04. o oxigênio, forma-se o peróxido de hidrogênio ou água oxigenada.
Questão 02. (Uepb PB/2005) Observe o esquema abaixo:
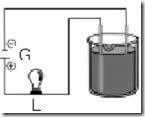
A força de um ácido é medida pelo seu grau de ionização (a), ou seja, pela relação entre o número de moléculas ionizadas e o número total de moléculas dissolvidas. Em qual das soluções – de mesma concentração e na mesma temperatura- a lâmpada (L) do esquema apresenta maior brilho?
a) HF
b) HNO3
c) H3PO4
d) H2S
e) H4SiO4
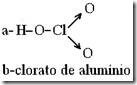
Questão 03. (Ufrj RJ/1996). O ácido clórico é um ácido forte, utilizado como catalisador em reações de polimerização e como agente oxidante. Soluções aquosas desse ácido pode causar grande irritação na pele e nas mucosas.
a) Represente a fórmula estrutural do ácido clórico.
b) Qual o nome do sal formado pela reação de neutralização do ácido clórico pelo hidróxido de alumínio?
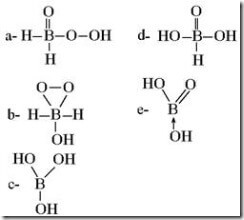
Questão 04 sobre Ácidos: (Umg MG/1989)Ácido bórico, H3BO3, tem a seguinte fórmula estrutural.
Questão 05. (Puc MG/1994). Para purificar a água, que apresenta impurezas biológicas, tais como fungos, algas e outros microorganismo, usa-se cloro. A reação do cloro com a água produz ácido clorídrico e ácido hipocloroso. Sobre os dois componentes produzidos, é INCORRETO afirmar:
a) As fórmulas do ácido clorídrico e hipocloroso são HCl e HClO, respectivamente.
b) O número e oxidação do átomo de cloro vale, respectivamente, -1 e +1.
c) A reação do cloro com água, produzindo HCl e HClO, é de auto oxi-redução.
d) As duas substâncias contém o mesmo número de átomos de cloro em 1 mol.
e) Um mol de ácido clorídrico tem maior massa que 1 mol de ácido hipocloroso.
Questão 06. (Unifesp SP/2003/1ªFase). Para distinguir uma solução aquosa de HF (ácido fraco) de outra de HCl (ácido forte), de mesma concentração, foram efetuados os seguintes procedimentos independentes com cada uma das soluções.
I. Determinação da temperatura de congelamento do solvente.
II. Medida de pH.
III. Teste com uma tira de papel tornassol azul.
IV. Medida de condutibilidade elétrica das soluções.
Os procedimentos que permitem distinguir entre essas soluções são:
a) I, II e IV, apenas.
b) II, III e IV, apenas.
c) II e IV, apenas.
d) III e IV, apenas.
e) IV, apenas.
Questão 07 sobre Ácidos: (Unama AM/2001) Freqüentemente, os médicos oftalmologistas recomendam o uso de “água boricada” para a assepsia dos olhos. Este medicamento é vendido sem restrições, nas farmácias, por se tratar de uma solução a 3% de H3BO3.
Outro emprego comum do H3BO3 é no combate caseiro às baratas. Essa substância é classificada como um:
a) sal
b) hidróxido
c) ácido
d) óxido
Questão 08. (ITA SP/1996). ÁQual dos ácidos abaixo é o menos volátil?
a) HCl.
b) HI.
c) H2SO3.
d) H2SO4.
e) CH3CH2COOH.
Questão 09. (Mackenzie SP/1998) Uma solução aquosa de HNO3 é acida devido à presença de:
a) íons nitrito
b) íons hidroxilas
c) íons hidroxônio
d) gás hidrogênio
e) moléculas de oxigênio
Questão 10 sobre Ácidos: (Mackenzie SP/1996). Ao se aplicar o conceito atualizado de Arrhenius a um ácido inorgânico, forma. se uma certa espécie química característica que:
a) é um cátion, no qual o número total de prótons é menor que o número total de elétrons
b) é um ânion, no qual o número total de elétrons é menor que o número total de prótons
c) é uma molécula polar
d) é um íon, no qual o número total de prótons é maior que o número total de elétrons
e) é um íon, no qual o número total de prótons é igual ao número total de elétrons
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões sobre Funções Químicas Ácidos:
01. 01-E; 02–C; 03-C; 04-E
02. B
04. C
05. E
06. A
07. C
08. D
RESOLUÇÃO
PE = 338ºC
09. C
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína