Questão 01 sobre a Natureza Elétrica da Matéria e Núcleo Atômico: (UFMG–2006) No fm do século XIX, Thomson realizou experimentos em tubos de vidro que continham gases a baixas pressões, em que aplicava uma grande diferença de potencial. Isso provocava a emissão de raios catódicos. Esses raios, produzidos num cátodo metálico, deslocavam-se em direção à extremidade do tubo (E).
Na figura, essa trajetória é representada pela linha tracejada X.
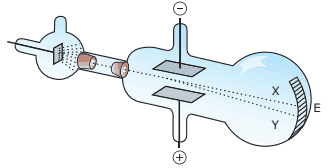
Nesses experimentos, Thomson observou que:
I. A razão entre a carga e a massa dos raios catódicos era independente da natureza do metal constituinte do cátodo ou do gás existente no tubo.
II. Os raios catódicos, ao passarem entre duas placas carregadas, com cargas de sinal contrário, se desviavam na direção da placa positiva.
Na figura, esse desvio é representado pela linha tracejada Y.
Considerando-se essas observações, é CORRETO afirmar que os raios catódicos são constituídos de:
A) elétrons.
B) ânions.
C) prótons.
D) cátions.
Questão 02. (FUVEST-SP) Em 1897, J. J. Thomson determinou, pela primeira vez, a relação entre a massa e a carga do elétron, o que pode ser considerado como a descoberta do elétron. É reconhecida como uma contribuição de Thomson ao modelo atômico:
A) o átomo ser indivisível.
B) a existência de partículas subatômicas.
C) os elétrons ocuparem níveis discretos de energia.
D) os elétrons girarem em órbitas circulares ao redor do núcleo.
E) o átomo possuir um núcleo com carga positiva e uma eletrosfera.
Questão 03. (UFMG) Os resultados da experiência de bombardeamento de uma lâmina de ouro com partículas alfa foram corretamente interpretados por Rutherford, em 1911. Todas as alternativas apresentam conclusões resultantes dessa experiência, EXCETO:
A) Os átomos têm núcleos densos e eletricamente positivos.
B) A matéria tem, em sua constituição, grandes espaços vazios.
C) Os elétrons se situam nos níveis de energia da eletrosfera.
D) O tamanho do núcleo é muito menor do que o tamanho do átomo.
E) A carga nuclear e a da eletrosfera têm valores iguais com sinais contrários.
Questão 04 sobre a Natureza Elétrica da Matéria e Núcleo Atômico: (UFMG) Na experiência de espalhamento de partículas alfa, conhecida como “experimento de Rutherford”, um feixe de partículas alfa foi dirigido contra uma lâmina finíssima de ouro, e os experimentadores (Geiger e Marsden) observaram que um grande número dessas partículas atravessava a lâmina sem sofrer desvios, mas que um pequeno número sofria desvios muito acentuados. Esse resultado levou Rutherford a modificar o modelo atômico de Thomson, propondo a existência de um núcleo de carga positiva, de tamanho reduzido e com, praticamente, toda a massa do átomo.
Assinale a alternativa que apresenta o resultado que era previsto para o experimento de acordo com o modelo de Thomson.
A) A maioria das partículas atravessaria a lâmina de ouro sem sofrer desvios, e um pequeno número sofreria desvios muito pequenos.
B) A maioria das partículas sofreria grandes desvios ao atravessar a lâmina.
C) A totalidade das partículas atravessaria a lâmina de ouro sem sofrer nenhum desvio.
D) A totalidade das partículas ricochetearia ao se chocar contra a lâmina de ouro, sem conseguir atravessá-la.
Questão 05. (UFLA-MG) As afirmações que se seguem dizem respeito a dois elementos A e B.
I. B possui massa atômica igual a 39.
II. O número atômico de A é igual a 20.
III. B é isoeletrônico com A+.
IV. A e B são isótonos.
Podemos afirmar que
A) A e B+ são isoeletrônicos.
B) o número de massa de A é igual a 40.
C) o número de elétrons de B é igual a 20.
D) o número de nêutrons de A é igual a 17.
E) A e B são isóbaros.
Questão 06. (PUC RS–2007) Um experimento conduzido pela equipe de Rutherford consistiu no bombardeamento de finas lâminas de ouro, para estudo de desvios de partículas alfa. Rutherford pôde observar que a maioria das partículas alfa atravessava a fina lâmina de ouro, uma pequena parcela era desviada de sua trajetória e uma outra pequena parcela era refletida. Rutherford então idealizou um outro modelo atômico, que explicava os resultados obtidos no experimento.
Em relação ao modelo de Rutherford, afirma-se que:
I. O átomo é constituído de duas regiões distintas: o núcleo e a eletrosfera.
II. O núcleo atômico é extremamente pequeno em relação ao tamanho do átomo.
III. Os elétrons estão situados na superfície de uma esfera de carga positiva.
IV. Os elétrons movimentam-se ao redor do núcleo em trajetórias circulares, denominadas níveis, com valores determinados de energia.
As afirmativas CORRETAS são, apenas:
A) I e II.
B) I e III.
C) II e IV.
D) III e IV.
E) I, II e III.
Questão 07 sobre a Natureza Elétrica da Matéria e Núcleo Atômico: (PUC Minas–2006) O modelo atômico de Rutherford NÃO inclui, especificamente:
A) nêutrons.
B) núcleo.
C) próton.
D) elétron.
Questão 08. (UFJF-MG–2010) Associe a coluna da esquerda, que descreve os modelos atômicos, com a da direita, em que se encontram os cientistas que as propuseram.
| Modelo | Cientista |
| A. Os átomos são partículas esféricas maciças e indivisíveis. | I. Modelo atômico de Rutherford |
| B. O átomo é formado por uma “pasta” positiva, “recheada” por elétrons de carga negativa. | II. Modelo atômico de Dalton |
| C. O átomo é formado por um pequeno núcleo denso e positivo e por elétrons que giram em torno desse núcleo. | III. Modelo atômico de Thomson |
A alternativa CORRETA é:
A) A-I, B-II, C-III.
B) A-II, B-III, C-I.
C) A-III, B-I, C-II.
D) A-III, B-II, C-I.
E) A-II, B-I, C-III.
Questão 09. (UFRGS) A experiência de Rutherford, que foi, na verdade, realizada por dois de seus orientados, Hans Geiger e Ernest Marsden, serviu para refutar especialmente o modelo atômico:
A) de Böhr.
B) de Thomson.
C) planetário.
D) quântico.
E) de Dalton.
Questão 10 sobre a Natureza Elétrica da Matéria e Núcleo Atômico: (ITA-SP) Considerando a experiência de Rutherford, assinale a afirmativa FALSA.
A) A experiência consistiu em bombardear películas metálicas delgadas com partículas alfa.
B) Observando o espectro de difração das partículas alfa, Rutherford concluiu que o átomo tem densidade uniforme.
C) Algumas partículas alfa foram desviadas do seu trajeto devido à repulsão exercida pelo núcleo positivo do metal.
D) Essa experiência permitiu descobrir o núcleo atômico e seu tamanho relativo.
E) Rutherford sabia antecipadamente que as partículas alfa eram carregadas positivamente.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre Natureza Elétrica da Matéria e Núcleo Atômico:
01. A;
02. B;
03. C;
04. A;
05. B;
06. A;
07. A;
08. B;
09. B;
10. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
