Questão 01 sobre Cálculos Químicos: (Enem) Em um rótulo de leite em pó integral, lê-se:
MODO DE PREPARAR
Coloque o leite instantâneo sobre água quente ou fria, previamente fervida. Mexa ligeiramente e complete com água a medida desejada.
Para um copo de 200 mL, coloque 2 colheres bem cheias (30 g).
Composição média do produto em pó
| gordura | 26% | sais minerais | 6% |
| proteínas | 30% | água | 3% no pó |
| lactose (C12H22O11) | 35% | lecitina | 0,2% no pó |
Supondo que a composição corresponda ao percentual em massa de cada componente e que a constante de Avogadro valha 6×1023, a quantidade em mol de lactose em dois copos de leite integral é igual a:
Dados: M(C) = 12 g.mol-1
M(O) = 16 g.mol-1
M(H) = 1 g.mol-1
A) 0,61 mol.
B) 0,122 mol.
C) 0,061 mol.
D) 0,00122 mol.
E) 6,1 mol.
Questão 02. (OBQ) Considerando que o elemento cloro tem massa atômica aproximada de 35,5 e apresenta os isótopos 35 e 37, pode-se afirmar que a abundância relativa do isótopo 37 é:
A) menor que 20%.
B) maior que 20% e menor que 40%.
C) maior que 40% e menor que 60%.
D) maior que 60% e menor que 80%.
E) maior que 80%.
Questão 03 sobre Cálculos Químicos: (OBQ) Uma amostra de dióxido de carbono, pesando 22,0 mg:
A) contém 3,01×1020 mol de CO2.
B) contém 3,01×1023 moléculas.
C) contém 6,02×1023 átomos de oxigênio.
D) ocupa o volume de 11,2 mL em CNTP.
E) ocupa o volume de 1,12 L em CNTP.
Questão 04. (UFV-MG) Joias de ouro são fabricadas a partir de ligas contendo, comumente, além desse metal, prata e cobre. Isso porque o ouro é um metal muito macio. Ouro 18 quilates, por exemplo, contém 75% de ouro, sendo o restante usualmente prata e cobre. Considerando uma pulseira que pesa 26,376 g, contendo 19,700 g de ouro, 4,316 g de prata e 2,540 g de cobre, a proporção de átomos de cada elemento (Au:Ag:Cu) nessa liga será:
A) 2,000:1,000:1,000.
B) 19,70:4,316:2,540.
C) 7,756:1,628:1,000.
D) 10,00:4,000:4,000.
E) 197,0:107,9:63,50.
Questão 05 sobre Cálculos Químicos: (FMTM-MG) O nitrogênio é um elemento essencial para o sistema biológico, sendo constituinte de aminoácido e de enzimas. Na atmosfera, é o principal componente na forma de moléculas diatômicas altamente estáveis, contudo, forma com o oxigênio diversos compostos gasosos. Uma mistura de gases foi preparada a partir de 22 g de N2O, 3,0 mol de moléculas de N2O4 e 2,4×1024 moléculas de NO2.
A quantidade total, em mol, de átomos de nitrogênio na mistura é:
A) 9,0.
B) 9,5.
C) 10,0.
D) 10,5.
E) 11,0.
Questão 06. (PUC Minas) O álcool etílico pode provocar alterações no organismo humano; acima de uma concentração de 0,46 g de álcool por litro de sangue, o risco de acidentes automobilísticos é duas vezes maior. Um adulto tem, em média, 7 litros de sangue. Para que uma pessoa possa tomar uma bebida alcoólica, sem cair na faixa de risco, deve ingerir até:
A) 5 g de álcool etílico.
B) 0,07 mol de moléculas de álcool etílico.
C) 35 g de álcool etílico.
D) 0,5 mol de moléculas de álcool etílico.
E) 0,1 mol de moléculas de álcool etílico.
Questão 07. (VUNESP-SP–2006) O número de elétrons existentes em 1,0 mol de hélio é, aproximadamente, igual a:
A) 2.
B) 4.
C) 1.
D) 12×1023.
E) 24×1023.
Questão 08 sobre Cálculos Químicos: (PUC Minas) Os motores a diesel lançam na atmosfera diversos gases, entre eles o dióxido de enxofre e o monóxido de carbono. Uma amostra dos gases emitidos por um motor a diesel foi recolhida. Observou-se que ela continha 0,2 mol de dióxido de enxofre e 3,0×1023 moléculas de monóxido de carbono. A massa total, em gramas, referente à amostra dos gases emitidos, é igual a:
A) 12,8.
B) 14,4.
C) 26,8.
D) 40,4.
Questão 09. (UCB-DF) A vitamina C (ácido ascórbico) é um composto orgânico muito usado na prevenção e no combate aos resfriados. Nos últimos tempos, várias pessoas têm tomado doses elevadas de vitamina C, na tentativa de prevenir doenças provocadas pela presença dos chamados radicais livres no organismo. Segundo os
médicos, a dose diária recomendada que uma pessoa adulta deve ingerir é de 60 mg. A fórmula estrutural da vitamina C é:
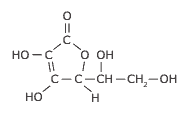
Com base na estrutura da vitamina C e na dose recomendada, DETERMINE o número de milimols de vitamina C que será ingerido por uma pessoa adulta, durante 30 dias.
Dados: C = 12,
O = 16,
H = 1.
Questão 10 sobre Cálculos Químicos: (Mackenzie-SP–2010) O ferro é um metal essencial para a vida, responsável pela formação da hemoglobina, da mioglobina e de certas enzimas. Apenas 8% do ferro ingerido são absorvidos e entram na corrente sanguínea. A dose diária recomendada é de cerca de 15 mg para adultos e de 30 mg para gestantes. Café ou chá em grandes quantidades inibem a absorção de ferro. O ferro ajuda no crescimento, promove a resistência às doenças, evita a fadiga, a anemia e garante uma boa tonalidade à pele. Supondo que uma colher de sopa de feijão possua cerca de 4,4×10-5 mol de ferro, uma gestante, para obter a quantidade diária de ferro recomendada, deverá ingerir:
Dado: Massa molar em g/mol: Fe = 56
A) 4 colheres de sopa de feijão.
B) 6 colheres de sopa de feijão.
C) 8 colheres de sopa de feijão.
D) 10 colheres de sopa de feijão.
E) 12 colheres de sopa de feijão.
Veja também esta seleção de exercícios de química:
- Propriedades Coligativas Questões Resolvidas;
- Exercícios sobre Misturas Gasosas, Efusão e Difusão;
- Exercícios sobre Soluções Químicas;
- Exercícios sobre a Classificação dos Elementos Químicos;
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos melhores exercícios sobre Cálculos Químicos para passar no Enem:
Gabarito do exercício 01. C;
Gabarito do exercício 02. B;
Gabarito do exercício 03. D;
Gabarito do exercício 04. D;
Gabarito do exercício 05. E;
Gabarito do exercício 06. B;
Gabarito do exercício 07. D;
Gabarito do exercício 08. C;
Gabarito do exercício 09. 10,23 milimols;
Gabarito do exercício 10. E;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína

Olá, tudo bem? Amei o material, trouxe temas relevantes. Porém tenho uma dúvida em relação de como seria a resolução da questão 9, tentei fazer por mudança de grandeza, mas meus valores deram 46,80 milimols e 0,19 milimols, errei feio, mas não sei como seria a resolução, pode me explicar por favor?
Desde já agradeço.