Questão 01 sobre Equilíbrio Iônico, PH e POH: (UFPR/2007) O vinagre (solução aquosa de ácido acético, CH3COOH, de constante de dissociação Ka = 1,8 × 10-5) é utilizado há muitos séculos, principalmente como condimento, como preservativo em alimentos e como agente de limpeza. Considerando-se que o vinagre possui uma concentração de 2% (m/v), ou seja, 2 g de ácido acético em 100 mL de solução, numere a segunda coluna de acordo com a primeira. (Massas atômicas: C = 12; H = 1; O = 16; (2,45 × 10-3)2= 6 × 10-6; log 2,45 = 0,389.)
1. pH da solução de vinagre.
2. Concentração da solução (em mol/L) de ácido acético.
3. Percentagem de ionização do ácido acético no vinagre.
4. Concentração do ácido acético (em mol/L) não ionizado.
( ) 0,75
( ) 2,6
( ) 0,330
( ) 0,333
Assinale a alternativa que apresenta a sequência correta da segunda coluna, de cima para baixo.
a) 2; 1; 4; 3.
b) 3; 2; 1; 4.
c) 1; 3; 4; 2.
d) 4; 3; 2; 1.
e) 2; 4; 1; 3.
Questão 02. (PUC-Rs/2007) Para neutralizar 10 litros de água de lavanderia com pH igual a 12, são necessários _________ litros de uma solução de ácido sulfúrico 0,1 mol/L.
a) 0,25.
b) 0,50.
c) 1,0.
d) 1,5.
e) 2,0.
Questão 03. (Fuvest/2008) Para indicar a acidez de uma solução, usa-se o pH, que informa a concentração de íons H+ que se encontram na solução. A água pura tem pH igual a 7, o que significa que existe 1 mol de H+ para cada 107 litros. Do mesmo modo, numa solução de pH igual a 3 existe 1 mol de H+ para cada 103 litros. Se determinada solução tem pH igual a 6, pode-se concluir que a concentração de íons H+ nessa solução é:
a) duas vezes maior que a existente em uma solução de pH = 3.
b) dez vezes maior que a existente em água pura.
c) mil vezes maior que a existente em uma solução de pH = 3.
d) três vezes menor que a existente em uma solução de pH = 3.
e) aproximadamente 16% menor que a existente em água pura.
Questão 04 sobre Equilíbrio Iônico, PH e POH: (Ita/2012) Considere uma amostra aquosa em equilíbrio a 60°C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH–.
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1 mol . L–1 em H2CO-3, considerando que a constante de dissociação do H2CO3 é da ordem de 1 . 10-7.
Das afirmações acima está(ão) correta(s) apenas
a) I, II e IV.
b) I e III.
c) II e IV.
d) III e V.
e) V.
Questão 05. (Ueg/2011) A presença de tampão é fundamental para manter a estabilidade de ecossistemas menores, como lagos, por exemplo. Íons fosfato, originários da decomposição da matéria orgânica, formam um tampão, sendo um dos equilíbrios expressos pela seguinte equação:
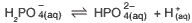
Se no equilíbrio foram medidas as concentrações molares ![]() [H+] = 0,2 mol . L-1, o valor da constante de equilíbrio é:
[H+] = 0,2 mol . L-1, o valor da constante de equilíbrio é:
a) 2
b) 0,2
c) 0,1
d) 0,01
Questão 06. (Fgv/2010) Uma solução aquosa de ácido cianídrico, HCN, a 25°C tem pH = 5. sabendo-se que a constante de ionização desse ácido, a 25°C, é 5 x 10-10, então essa solução tem concentração de HCN, em g/L, igual a:
a) 2,7.
b) 5,4.
c) 8,1.
d) 10,8.
e) 13,5.
Questão 07 sobre Equilíbrio Iônico, PH e POH: (Ufu/2010) Pesquisadores descobriram que os atletas que bebem água somente para saciar a sede, sem considerar a água perdida pelo suor nos exercícios, apresentam resistência física menor quando comparados àqueles que consomem água em quantidade adequada. Por outro lado, atletas que bebem mais água têm mais disposição física e sua temperatura corporal permanece perto da normal, pois o corpo utiliza a água para manter adequado o pH dos fluidos biológicos também, o equilíbrio químico das substâncias do organismo.
Já o consumo de outras bebidas, como sucos e refrigerantes, não provoca o mesmo efeito que o consumo de água. Essas bebidas, além de outras substâncias, contêm açúcar, o qual pode retardar a digestão, contribuir para o ganho de peso e provocar oscilação nos níveis de glicose do organismo. Além disso, os refrigerantes do tipo “cola” possuem, em sua composição, ácido fosfórico (H3PO4) que pode prejudicar o teor de cálcio no corpo, pois os ânions oriundos da ionização do ácido fosfórico reagem com o cálcio dos ossos, enfraquecendo-os. O ácido fosfórico é um poliácido e suas constantes de ionização são iguais a: K1 = 7,5 x 10-3, K2= 6,2 x 10-8 e K3 = 5,0 x 10-13. se não tomarmos água suficiente, os rins têm de trabalhar mais arduamente para eliminar substâncias tóxicas do organismo. A quantidade adequada de água ingerida pode ser verificada, grosso modo, pela perda acentuada da cor amarela característica da urina.
A partir do texto, assinale a alternativa correta.
a) A primeira constante de ionização do ácido fosfórico é inversamente proporcional à sua força ácida.
b) A falta de água no organismo induz a doenças, porque as espécies vitais mudam suas concentrações e, consequentemente, o equilíbrio químico no interior do corpo.
c) O pH do estômago permanece inalterado quando ingerimos líquidos em grande quantidade durante nossas refeições.
d) A urina mais clara indica uma maior concentração de substâncias eliminadas pelo organismo.
Questão 08. (Cesgranrio/2010) A maior parte do CO2 produzido no metabolismo celular, cerca de 80%, é transportada pelo sangue, dissolvido na forma de íon bicarbonato (HCO–3 ), e o restante, sob a forma de carboxiemoglobina (HbCO2). O CO2 reage rapidamente com a água contida no sangue através da seguinte reação:
anidrase carbônica
H2O(l) + CO2(g) H2CO3 H+(aq) + HCO–3(aq)
Assim, analisando a equação, conclui-se que o(a):
a) equilíbrio representado pela equação é influenciado diretamente pela concentração dos íons H+, em virtude de formar um sistema tampão, sofrendo uma grande variação de pH.
b) H2CO3 é um ácido fraco, pois se dissocia completamente em meio aquoso, produzindo altas concentrações de H+.
c) aumento da concentração de CO2 no sangue deslocaria o equilíbrio para a direita, aumentando a concentração de H+ e diminuindo o pH.
d) aumento da concentração de íons bicarbonato no sangue deslocaria o equilíbrio para a esquerda, aumentando a concentração de íons H+ e diminuindo o pH.
e) anidrase carbônica apresenta ação catalítica por não alterar os estados de transição na reação química.
Questão 09. (Fuvest 2013) O fitoplâncton consiste em um conjunto de organismos microscópicos encontrados em certos ambientes aquáticos. O desenvolvimento desses organismos requer luz e CO2, para o processo de fotossíntese, e requer também nutrientes contendo os elementos nitrogênio e fósforo.
Considere a tabela que mostra dados de pH e de concentrações de nitrato e de oxigênio dissolvidos na água, para amostras coletadas durante o dia, em dois diferentes pontos (A e B) e em duas épocas do ano (maio e novembro), na represa Billings, em são Paulo.
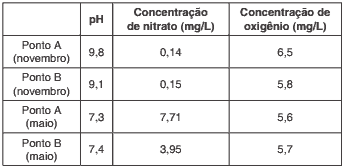
Com base nas informações da tabela e em seus próprios conhecimentos sobre o processo de fotossíntese, um pesquisador registrou três conclusões:
I. Nessas amostras, existe uma forte correlação entre as concentrações de nitrato e de oxigênio dissolvidos na água.
II. As amostras de água coletadas em novembro devem ter menos CO2 dissolvido do que aquelas coletadas em maio.
III. se as coletas tivessem sido feitas à noite, o pH das quatro amostras de água seria mais baixo do que o observado.
É correto o que o pesquisador concluiu em:
a) I, apenas.
b) III, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
Questão 10 sobre Equilíbrio Iônico, PH e POH: (Pucsp 2012) Em um béquer são misturados 250 mL de solução aquosa de hidróxido de bário (Ba(OH)2) de concentração 0,1 mol/L, 150 mL de solução aquosa de ácido nítrico (HNO3) de concentração 0,2 mol/L e 100 mL de solução aquosa de ácido clorídrico de concentração 0,18 mol/L.
A solução resultante apresenta pH:
a) entre 1 e 2.
b) entre 2 e 3.
c) igual a 7.
d) entre 11 e 12.
e) entre 12 e 13.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios de química sobre Equilíbrio Iônico, PH e POH:
01. e;
02. b;
03. b;
04. a;
05. c;
06. b;
07. b;
08. c;
09. d;
10. d
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
