Questões sobre Cinética Química: 01. (UFMG) A rapidez de decomposição do óxido de nitrogênio (V), N2O5 → N2O4 + 1/2O2, foi estudada a 35 ºC, sendo obtidos os seguintes dados:Tempo (s) Concentração de N2O5 em mol.L-1 0 2,35 180 2,05 360 1,90 540 1,72
A rapidez média da reação no intervalo de tempo correspondente a 360 para 540 segundos é igual a
A) 2,2×10-4 mol.L-1.s-1.
B) 1,0×10-3 mol.L-1.s-1.
C) 3,0×10-3 mol.L-1.s-1.
D) 6,0×10-3 mol.L-1.s-1.
E) 1,8×10-1 mol.L-1.s-1.
Questão 02. (UniCEUB-DF) Num recipiente fechado, ocorre a reação de síntese da amônia:
N2(g) + H2(g) → NH3(g)
Verifica-se que 0,20 mol de N2(g) são consumidos num intervalo de 5 minutos. As velocidades médias (mol.min-1) da reação de consumo do N2(g) e do H2(g) são, respectivamente:
A) 0,02 e 0,04.
B) 0,04 e 0,12.
C) 0,02 e 0,06.
D) 0,40 e 1,2.
E) 2 e 3.
Questão 03. (FMU-SP) O gráfico a seguir mostra a variação da quantidade de matéria de reagente em função do tempo, numa reação química.
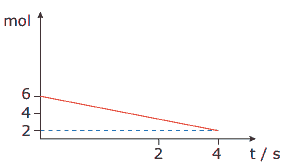
A rapidez média dessa reação é:
A) –1 mol.s-1.
B) 1 mol.s-1.
C) 2 mol.s-1.
D) 4 mol.s-1.
E) –4 mol.sv.
Questão 04. (USC) Um químico realizou a reação de decomposição do H2CO3:
H2CO3 → H2O + CO2
Mediu a concentração molar do CO2 nos tempos 10 s e 20 s e obteve:
10 s → [CO2] = 0,2 mol.L-1
20 s → [CO2] = 0,8 mol.L-1
Qual é a velocidade média dessa reação no intervalo de 10 s a 20 s?
Questões sobre Cinética Química: 05. (Enem–1999) A obsidiana é uma pedra de origem vulcânica que, em contato com a umidade do ar, fixa água em sua superfície, formando uma camada hidratada.
A espessura da camada hidratada aumenta de acordo com o tempo de permanência no ar, propriedade que pode ser utilizada para medir sua idade. O gráfico a seguir mostra como varia a espessura da camada hidratada, em mícrons (1 mícron = 1 milésimo de milímetro) em função da idade da obsidiana.
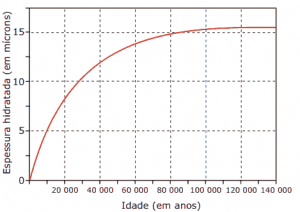
Com base no gráfico, pode-se concluir que a espessura da camada hidratada de uma obsidiana:
A) é diretamente proporcional à sua idade.
B) dobra a cada 10 000 anos.
C) aumenta mais rapidamente quando a pedra é mais jovem.
D) aumenta mais rapidamente quando a pedra é mais velha.
E) a partir de 100 000 anos não aumenta mais.
Questão 06. (Enem) A eficiência na administração oral de um medicamento leva em conta vários parâmetros, entre os quais:
o tempo para se atingir a concentração máxima na corrente sanguínea; a concentração mínima efetiva (CME), que é a concentração mínima necessária para que o paciente apresente resposta adequada ao medicamento; a quantidade total de medicamento no sangue após a sua administração. O diagrama a seguir mostra a variação da concentração no sangue (microgramas por mililitro, μg.mL-1), em função do tempo, para a mesma quantidade de um mesmo medicamento em duas formulações diferentes.
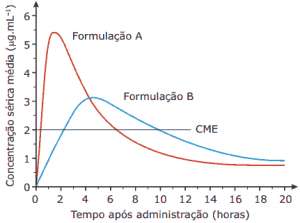
Texto e gráfico extraídos do vestibular Unicamp-SP–2006.
A partir das informações dadas, avalie as seguintes afirmativas:
I. A absorção é mais rápida no caso da formulação A.
II. A formulação que permite um maior tempo de manutenção da concentração mínima efetiva (CME) é a B.
III. Considerando que o tratamento deve se prolongar por sete dias e que as cápsulas de ambas as formulações têm a mesma quantidade do medicamento, custam o mesmo preço e podem ser compradas por unidade, pode-se afirmar que o tratamento com a formulação A custaria menos.
É correto o que se afirma:
A) apenas em I.
B) apenas em I e II.
C) apenas em I e III.
D) apenas em II e III.
E) em todos os itens.
Questão 07. (PUC Minas–2007) Durante a decomposição da água oxigenada, ocorre a formação de água e oxigênio, de acordo com a equação:
2H 2O2(aq) → 2H2O(l) + O2(g)
Se a velocidade de liberação de oxigênio é 1×10-4 mol.s-1, a velocidade de consumo da água oxigenada em mol.s-1 é:
A) 0,5×10-4.
B) 1×10-4.
C) 2×10-4.
D) 3×10-4.
Questão 08. (FUVEST-SP) Para uma dada reação química, expressa como A → B, sabe-se que a concentração de A reduz-se à metade em cada intervalo de 30 minutos.
A) Se a concentração inicial de A for de 1,00 mol.L-1, após quanto tempo ela atingirá o valor de 0,125 mol.L-1?
B) A velocidade dessa reação é constante, aumenta ou diminui com o tempo? JUSTIFIQUE sua resposta.
Questão 09. (UFMG–2006) Analise este gráfico, em que está representada a variação da concentração de um reagente em função do tempo em uma reação química:
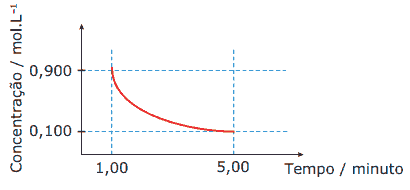
Considerando-se as informações desse gráfico, é CORRETO afirmar que, no intervalo entre 1 e 5 minutos, a velocidade média de consumo desse reagente é de:
A) 0,200 mol.L-1.min-1.
B) 0,167 mol.L-1.min-1.
C) 0,225 mol.L-1.min-1.
D) 0,180 mol.L-1.min-1.
Questões sobre Cinética Química: 10. (Enem–2009) Analise a figura.
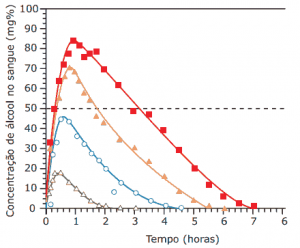
Disponível em: <http//www.alcoologia.net>. Acesso em: 15 jul. 2009 (Adaptação).
Supondo que seja necessário dar um título para essa figura, a alternativa que melhor traduziria o processo representado seria:
A) Concentração média de álcool no sangue ao longo do dia
B) Variação da frequência da ingestão de álcool ao longo das horas
C) Concentração mínima de álcool no sangue a partir de diferentes dosagens
D) Estimativa de tempo necessário para metabolizar diferentes quantidades de álcool
E) Representação gráfica da distribuição de frequência de álcool em determinada hora do dia
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do Simulado das Questões sobre Cinética Química para passar no Enem e Vestibular:
01. B;
02. B;
03. A;
04. 0,06 mol.L-1.s-1;
05. C;
06. B;
07. C;
08. A) 90 minutos
B) Ao calcularmos a velocidade média de consumo do reagente A em intervalos de tempo de 30 minutos, percebe-se que a mesma é menor, ou seja, a velocidade instantânea de consumo de A diminui com o passar do tempo.
09. A;
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
