Questão 01 sobre os Tipos de Equilíbrios Químicos: (UFV-MG–2009) O metanol, usado como combustível, pode ser obtido industrialmente pela hidrogenação do monóxido de carbono, de acordo com a equação representada a seguir:
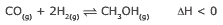
Assinale a afirmativa INCORRETA.
A) A diminuição da temperatura favorece a produção do metanol.
B) O aumento da pressão total sobre o sistema favorece a produção do monóxido de carbono.
C) O aumento da concentração de H2 aumenta a concentração de metanol no equilíbrio.
D) Trata-se de uma reação exotérmica.
Questão 02. (PUC RS) O monóxido de dinitrogênio, quando inalado em pequenas doses, produz uma espécie de euforia, daí ser chamado de gás hilariante. Ele pode ser obtido por meio da decomposição do nitrato de amônio, conforme equação representada a seguir:
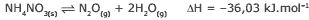
Com relação a essa reação em equilíbrio, está CORRETO afirmar que:
A) a produção de monóxido de dinitrogênio aumenta com o aumento de temperatura.
B) a adição de um catalisador aumenta a formação do gás hilariante.
C) o equilíbrio químico é atingido quando as concentrações dos produtos se igualam.
D) um aumento na concentração de água desloca o equilíbrio químico no sentido da reação de formação do monóxido de dinitrogênio.
E) uma diminuição na concentração de monóxido de dinitrogênio desloca o equilíbrio químico no sentido da reação de decomposição do nitrato de amônio.
Questão 03 sobre os Tipos de Equilíbrios Químicos: (UFRGS) Uma reação química atinge o equilíbrio químico quando:
A) ocorre simultaneamente nos sentidos direto e inverso.
B) as velocidades das reações direta e inversa são iguais.
C) os reagentes são totalmente consumidos.
D) a temperatura do sistema é igual à do ambiente.
E) a razão entre as concentrações de reagentes e produtos é unitária.
Questão 04. (UFJF-MG–2010) O gás incolor N2O4, em presença de calor, decompõe-se em dióxido de nitrogênio gasoso, que possui coloração castanha. Em uma experiência de laboratório, o gás N2O4 foi colocado em um cilindro transparente fechado à temperatura ambiente, e esperou-se que o sistema atingisse o equilíbrio.
Para que seja observado aumento da coloração castanha nesse sistema, é necessário:
A) colocar o cilindro em um banho de gelo.
B) adicionar um gás inerte no cilindro.
C) adicionar um catalisador.
D) diminuir o volume do cilindro.
E) diminuir a pressão dentro do cilindro.
Questão 05 sobre os Tipos de Equilíbrios Químicos: (UFMG) O gráfico a seguir ilustra a variação da concentração, no equilíbrio, de um determinado produto X de uma reação química, com as variações de pressão e temperatura. Reagentes e produtos são todos gasosos. Do exposto anteriormente e da análise do gráfico, pode-se concluir CORRETAMENTE que:
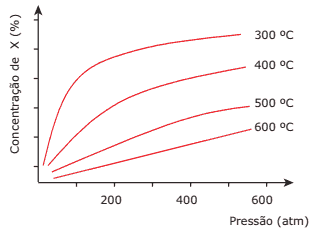
A) a reação, na direção da produção de X, é endotérmica.
B) o aumento da pressão faz o equilíbrio deslocar-se na direção dos reagentes.
C) na equação química balanceada, o número total de mols dos produtos é menor do que o de reagentes.
D) a temperaturas suficientemente baixas, poder-se-ia obter 100% de X.
E) a adição de um catalisador aumentaria a concentração de X em qualquer temperatura.
Questão 06. (UFF-RJ–2008) Nas células do nosso corpo, o dióxido de carbono é produto final do metabolismo. Uma certa quantidade desse composto é dissolvida no sangue e a reação que se processa é:
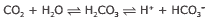
Esses equilíbrios mantêm o valor do pH do sangue em torno de 7,5. Numa situação de incêndio, há um aumento na inalação de gás carbônico, acarretando elevação dos níveis de CO2 no sangue. Nesse caso, o indivíduo sofre “acidose”. O contrário é a “alcalose”. Com base nas informações, assinale a opção CORRETA.
A) O valor normal do pH do sangue é ácido.
B) A acidose é provocada quando o equilíbrio se desloca para a direita.
C) Tanto na alcalose quanto na acidose, a posição de equilíbrio não sofre alteração.
D) A alcalose tem como responsável o aumento de [CO2].
E) O pH normal do sangue independe dos valores de [CO2].
Questão 07 sobre os Tipos de Equilíbrios Químicos: (UNESP–2008) Dada a reação exotérmica:
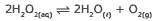
A alteração que favorece a formação dos produtos é a elevação da:
A) temperatura.
B) pressão parcial de O2.
C) concentração de H2O.
D) pressão.
E) concentração de H2O2.
Questão 08. (UFV-MG–2010) O crômio, com número de oxidação igual a +6, forma espécies com algumas propriedades diferentes, como o cromato, CrO42–, e o dicromato, Cr2O72–. Essas espécies, em solução aquosa, estão em equilíbrio, podendo o equilíbrio ser modificado acidificando-se ou basificando-se o meio.
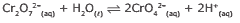
A solução de dicromato é alaranjada e o seu sal de bário é solúvel em água. A solução de cromato é amarelada e o seu sal de bário é pouco solúvel em água.
Se numa solução de dicromato de bário for adicionado ácido ou base, modificando o seu pH, é POSSÍVEL prever que:
A) adicionando-se HCl, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon dicromato, que na presença do íon bário formará um composto pouco solúvel.
B) adicionando-se NaOH, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon cromato, que na presença do íon bário formará um composto pouco solúvel.
C) adicionando-se NaOH, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon dicromato, que na presença do íon bário permanecerá solúvel.
D) adicionando-se HCl, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon cromato, que na presença do íon bário permanecerá solúvel.
Questão 09. (Enem–2009) Sabões são sais de ácidos carboxílicos de cadeia longa utilizados com a finalidade de facilitar, durante processos de lavagem, a remoção de substâncias de baixa solubilidade em água, por exemplo, óleos e gorduras. A figura a seguir representa a estrutura de uma molécula de sabão.

Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
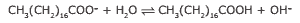
Uma vez que o ácido carboxílico formado é pouco solúvel em água e menos eficiente na remoção de gorduras, o pH do meio deve ser controlado de maneira a evitar que o equilíbrio anterior seja deslocado para a direita.
Com base nas informações do texto, é CORRETO concluir que os sabões atuam de maneira:
A) mais eficiente em pH básico.
B) mais eficiente em pH ácido.
C) mais eficiente em pH neutro.
D) eficiente em qualquer faixa de pH.
E) mais eficiente em pH ácido ou neutro.
Questão 10 sobre os Tipos de Equilíbrios Químicos: (Enem–2010) Às vezes, ao abrir um refrigerante, percebe-se que uma parte do produto vaza rapidamente pela extremidade do recipiente. A explicação para esse fato está relacionada à perturbação do equilíbrio químico existente entre alguns dos ingredientes do produto, de acordo com a equação:
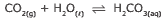
A alteração do equilíbrio anterior, relacionada ao vazamento do refrigerante nas condições descritas, tem como consequência a:
A) liberação de CO2 para o ambiente.
B) elevação da temperatura do recipiente.
C) elevação da pressão interna no recipiente.
D) elevação da concentração de CO2 no líquido.
E) formação de uma quantidade significativa de H2O.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre Tipos de Equilíbrios Químicos:
01. B;
02. E;
03. B;
04. E;
05. C;
06. B;
07. E;
08. B;
09. A;
10. A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
