Questão 01 sobre Antiga Teoria Quântica: (Fafeod-MG) O desenho a seguir representa o espectro atômico do elemento potássio, em sua porção visível.
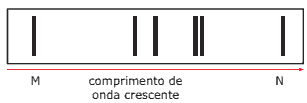
Em relação a esse espectro, são apresentadas as seguintes afirmativas:
I. As seis linhas verticais representam radiação eletromagnética emitida pelos elétrons.
II. A linha M corresponde à radiação eletromagnética mais energética da porção de espectro apresentada.
III. A análise de espectros como esses está na base do desenvolvimento do modelo atômico de Thomson.
IV. As seis linhas verticais representam diferentes subníveis do átomo de potássio.
Analisando as afirmativas anteriores e considerando que a energia é inversamente proporcional ao comprimento de onda, é CORRETO afirmar que são verdadeiras apenas as afirmativas:
A) I, II e III.
B) I e III.
C) I, III e IV.
D) I e II.
E) III e IV.
Questão 02. (UFMG) Considere os níveis de energia eletrônica do átomo de hidrogênio, ilustrados na figura a seguir:
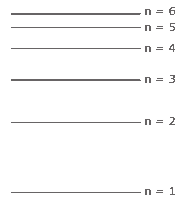
Considerando excitações do elétron que envolvam apenas esses níveis, o número MÁXIMO de linhas de emissão é:
A) 21.
B) 15.
C) 10.
D) 6.
E) 5.
Questão 03 sobre Antiga Teoria Quântica: (UFOP-MG) O modelo atômico de Böhr apresenta todas essas características, EXCETO
A) O átomo apresenta núcleo positivo.
B) Os átomos são indivisíveis.
C) A explicação de transições eletrônicas que apresenta é superior à de Rutherford.
D) O elétron, quando em seu nível, não ganha energia de forma espontânea.
Questão 04. (UFSJ-MG–2008) Considere a informação a seguir:
O sódio, em determinadas condições, emite luz amarela característica, como aquelas observadas em lâmpadas de iluminação urbana ou em fogos de artifício. Esse fenômeno, em termos de elétrons e de níveis de energia, é MELHOR explicado na alternativa:
A) De acordo com o modelo de Böhr, a radiação é devida a elétrons de sódio, que saltam de uma camada mais externa para uma mais interna ao ganharem energia e a emitem de forma quantizada no comprimento de onda específico da cor amarela.
B) De acordo com o modelo de Rutherford, a radiação emitida é devida a elétrons de sódio, que são removidos do átomo quando um feixe incidente de partículas alfa atinge esse átomo.
C) De acordo com o modelo de Rutherford, a radiação emitida depende do núcleo do elemento e é devida ao ganho de energia de elétrons que saltam de uma camada mais externa para uma camada mais interna do átomo, com a absorção de energia.
D) De acordo com o modelo de Böhr, a radiação emitida é devida a elétrons do sódio que saltam de uma camada mais interna para uma mais externa, com a absorção de energia e, ao perderem essa energia, emitem radiação sob a forma de luz amarela.
Questão 05 sobre Antiga Teoria Quântica: (UFPR–2011) A constituição elementar da matéria sempre foi uma busca do homem. Até o início do século XIX, não se tinha uma ideia concreta de como a matéria era constituída. Nas duas últimas décadas daquele século e início do século XX, observou-se um grande avanço das ciências e com ele a evolução dos modelos atômicos.
Acerca desse assunto, numere a primeira coluna de acordo com sua correspondência com a segunda coluna.
1. Próton
2. Elétron
3. Átomo de Dalton
4. Átomo de Rutherford
5. Átomo de Böhr
( ) Partícula de massa igual a 9,109×10-31 kg e carga elétrica de –1,602×10-19 C.
( ) Partícula constituída por um núcleo contendo prótons e nêutrons, rodeado por elétrons que circundam em órbitas estacionárias.
( ) Partícula indivisível e indestrutível durante as transformações químicas.
( ) Partícula de massa igual a 1,673×10-27kg, que corresponde à massa de uma unidade atômica.
( ) Partícula que possui um núcleo central dotado de cargas elétricas positivas, sendo envolvido por uma nuvem de cargas elétricas negativas.
Assinale a alternativa que apresenta a numeração CORRETA da coluna, de cima para baixo.
A) 2 – 5 – 3 – 1 – 4
B) 1 – 3 – 4 – 2 – 5
C) 2 – 4 – 3 – 1 – 5
D) 2 – 5 – 4 – 1 – 3
E) 1 – 5 – 3 – 2 – 4
Questão 06. (UFOP-MG–2006) A diferença entre os modelos de Rutherford e de Böhr tem a ver com:
A) eletromagnetismo.
B) a quantização da energia.
C) a existência dos subníveis.
D) a atração do núcleo pelos elétrons.
Questão 07 sobre Antiga Teoria Quântica: (UNESP–2006) O sucesso do modelo atômico de Niels Böhr estava na explicação da emissão de luz pelos átomos. A emissão de luz é provocada por uma descarga elétrica através do gás sob investigação. Böhr desenvolveu um modelo do átomo de hidrogênio que lhe permitiu explicar esse fenômeno.
A) DESCREVA o modelo de Böhr.
B) DESCREVA o que ocorre, segundo o modelo do átomo de Böhr, com o elétron do hidrogênio quando submetido à descarga elétrica.
Questão 08. (UFMG) O gráfico que MELHOR descreve a variação da energia do elétron no átomo de hidrogênio, em função do número de ordem do nível de energia, é:
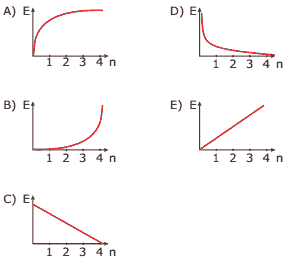
Questão 09. (FEPECS-DF–2007) Algumas substâncias, quando sujeitas a radiações ultravioletas, emitem luz visível. Os átomos dessas substâncias fluorescentes absorvem a radiação ultravioleta, invisível para o olho humano, e irradiam radiação visível para o ser humano. Esse fenômeno físico é chamado de fluorescência.
Outras substâncias, chamadas fosforescentes, demoram de minutos a algumas horas para que ocorra a emissão de luz. Devido a essas propriedades – de fluorescência e de fosforescência –, essas substâncias são utilizadas, por exemplo, para fazer com que ponteiros de relógios sejam visíveis à noite, para detectar falsificações em notas ou em bilhetes, e nos uniformes dos garis.
Esse fenômeno deve-se ao fato de que, após absorverem a radiação ultravioleta, os elétrons:
A) passam a uma nova órbita, liberando o seu excesso de energia na forma de fótons.
B) se mantêm em sua órbita, liberando energia na forma de fótons.
C) relaxam e voltam à sua órbita inicial, liberando o seu excesso de energia na forma de fótons.
D) se mantêm em sua órbita, absorvendo energia na forma de ondas eletromagnéticas.
E) escapam de sua órbita, liberando energia térmica.
Questão 10 sobre Antiga Teoria Quântica: (ITA-SP) Um átomo de hidrogênio com o elétron inicialmente no estado fundamental é excitado para um estado com número quântico principal (n) igual a 3. Em relação a esse fato, qual das alternativas a seguir é a CORRETA?
A) Esse estado excitado é o primeiro estado excitado permitido para o átomo de hidrogênio.
B) A distância média do elétron ao núcleo será menor no estado excitado do que no estado fundamental.
C) Será necessário fornecer mais energia para ionizar o átomo a partir desse estado excitado do que para ionizá-lo a partir do estado fundamental.
D) A energia necessária para excitar um elétron do estado com n = 3 para um estado com n = 5 é a mesma para excitá-lo do estado n = 1 para um estado com n = 3.
E) O comprimento de onda da radiação emitida quando esse elétron retornar para o estado fundamental será igual ao comprimento de onda da radiação absorvida para ele ir do estado fundamental para o mesmo estado excitado.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das atividades de Química sobre a Antiga Teoria Quântica:
01. D;
02. B;
03. B;
04. D;
06. B;
07. A) No modelo atômico de Niels Böhr, existem elétrons circulando em órbitas, com valores discretos de energia, ao redor de um pequeno núcleo positivo de grande massa. Ao girar em uma mesma órbita, o elétron não ganha nem perde energia. B) Submetido à descarga elétrica, o elétron passa para uma órbita mais afastada do núcleo e mais energética. Ao retornar à órbita original, a energia absorvida é emitida na forma de radiação eletromagnética.
08. A;
09. C;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
