Questão 01 sobre Oxirredução: (PUC-Rs/2008) O bafômetro é um aparelho utilizado para medir a quantidade de álcool etílico na corrente sanguínea. A quantidade de álcool presente no ar expirado é proporcional à quantidade de álcool presente no sangue. Os bafômetros mais modernos funcionam com pilhas de combustível, e a corrente elétrica é proporcional à quantidade de álcool que reage. As reações estão representadas pelas equações:
C2H6O + 4 OH– → C2H4O2 + 3 H2O + 4 e– O2 + 2 H2O + 4 e– → 4 OH–
Em relação às reações que ocorrem no bafômetro, é correto afirmar que:
a) o oxigênio reage no ânodo.
b) o álcool é o agente redutor.
c) o álcool reage no polo positivo.
d) a redução ocorre no polo negativo.
e) o fluxo de elétrons é do cátodo para o ânodo.
Questão 02. (Unesp/2008) O nitrogênio pode existir na natureza em vários estados de oxidação. Em sistemas aquáticos, os compostos que predominam e que são importantes para a qualidade da água apresentam o nitrogênio com números de oxidação -3, 0, +3 ou +5. Assinale a alternativa que apresenta as espécies contendo nitrogênio com os respectivos números de oxidação, na ordem descrita no texto.
a) NH3, N2, NO–2 , NO–3 .
b) NO–2 , NO–3 , NH3, N2.
c) NO–3 , NH3, N2, NO–-2 .
d) NO–2 , NH3, N2, NO–3 .
e) NH3, N2, NO–3 , NO–2 .
Questão 03. (ITA/2008) Considere as reações químicas representadas pelas equações a seguir:
I. H3CCHCH2 + HI → H3CCHICH3
II. H3CCOOH + NaOH → H3CCOONa + H2O
III. LiAlH4 + 4(H3C)2CO + 4 H2O → 4(H3C)2CHOH + LiOH + Al(OH)3
IV. C 6H6ONa + CH3CH2Cl → C6H6OCH2CH3 + NaCl
V. H3CCH2OH + HCl → H3CCH2Cl + H2O
Assinale a opção que apresenta as equações químicas que configuram reações de oxidorredução.
a) Apenas I e II.
b) Apenas I e III.
c) Apenas II e IV.
d) Apenas III e IV.
e) Apenas V.
Questão 04 sobre Oxirredução: (Unesp 2011) A bateria de níquel-cádmio (pilha seca), usada rotineiramente em dispositivos eletrônicos, apresenta a seguinte reação de oxirredução
Cd(s) + NiO2(s) + 2 H2O(l) → Cd(OH)2 + Ni(OH2)(s)
O agente oxidante e o agente redutor dessa reação, respectivamente, são:
a) H2O(l), Cd(OH)2(s)
b) NiO2(s), Cd(OH)2(s)
c) NiO2(s), Cd(s)
d) Cd(s), Cd(OH)2(s)
e) NiO2(s), Ni(OH)2(s)
Questão 05. (Aman-2011) Dada a seguinte equação de óxido-redução:
Cr(OH)3(aq) + IO1-3(aq) + OH1-(aq) → CrO42-(aq) + I1(aq) − + H2O(l)
Considerando o método de balanceamento de equações químicas por oxi-redução, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas, após o balanceamento da equação iônica, e o agente oxidante são, respectivamente:
a) 15 e o íon iodato.
b) 12 e o hidróxido de crômio.
c) 12 e o íon hidroxila.
d) 11 e a água.
e) 10 e o íon hidroxila.
Questão 06. (Uel 2011) Durante atividades físicas, o aumento da temperatura do corpo e a consequente transpiração promovem a oxidação de gorduras acumuladas sobre a pele. As equações químicas de oxidação do ácido oleico, gordura presente na pele, são mostradas a seguir.
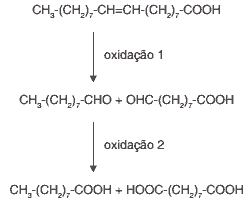
Dado: Temperatura de fusão do ácido oleico = 14°C
Com base no enunciado e nas equações químicas, assinale a alternativa correta.
a) Os carbonos da dupla ligação do ácido oleico tornam-se carbonos terciários nos produtos das oxidações 1 e 2.
b) A cadeia longa do hidrocarboneto que constitui o ácido oleico o torna solúvel em água.
c) Os produtos da oxidação 1 possuem os grupos funcionais álcool e éster.
d) O ácido oleico é um sólido à temperatura ambiente (25°C).
e) O número de oxidação do carbono do radical −CHO é menor que o número de oxidação do carbono do radical − COOH.
Questão 07 sobre Oxirredução: (Ufpr 2011) Um dos principais mecanismos de degradação de compostos orgânicos (aqui representado pela forma genérica de hidrato de carbono “CH2O”) em ambientes na ausência de oxigênio é expresso pela equação química não-balanceada abaixo:
CH2O + SO42- + H+ → CO2 + Hs– + H2O ∆G° = -25,5 kJ.mol-1
Com base nas informações fornecidas, considere as seguintes afirmativas:
1. O agente oxidante da reação é SO4 2− .
2. O agente redutor da reação é H+.
3. O número de oxidação do elemento enxofre no íon Hs– é igual a +2.
4. A reação acima é espontânea, de acordo com a lei de Gibbs.
5. A equação corretamente balanceada é:
2 CH 2O + SO42- H+ → 2 CO2 + Hs– + 2 H2O.
Assinale a alternativa correta.
a) Somente as afirmativas 3 e 5 são verdadeiras.
b) Somente as afirmativas 1, 3 e 4 são verdadeiras.
c) Somente as afirmativas 1, 2 e 3 são verdadeiras.
d) Somente as afirmativas 1, 4 e 5 são verdadeiras.
e) Somente as afirmativas 2, 4 e 5 são verdadeiras.
TEXTO PARA A PRÓXIMA QUESTÃO:
Dióxido de chumbo, PbO2, composto empregado na fabricação de baterias automotivas, pode ser obtido em laboratório a partir de restos de chumbo metálico pela seguinte sequência de reações: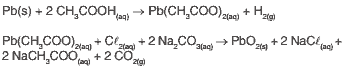
Questão 08. (Ifsp 2011) No conjunto das duas reações (reação global), partindo-se de PbO2(s) e chegando-se a, o número de oxidação do chumbo varia de:
a) 0 para + 3.
b) 0 para + 4.
c) + 3 para + 4.
d) − 2 para − 4.
e) − 4 para 0.
Questão 09. (Fuvest 2010) Na produção de combustível nuclear, o trióxido de urânio é transformado no hexafluoreto de urânio, como representado pelas equações químicas: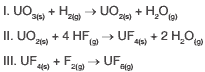
Sobre tais transformações, pode-se afirmar, corretamente, que ocorre oxirredução apenas em:
a) I.
b) II.
c) III.
d) I e II.
e) I e III.
Questão 10 sobre Oxirredução: (Ufrgs 2010) Em fogo provocado por sódio metálico não devem ser utilizados extintores de incêndio à base de gás carbônico, pois esse gás pode reagir com o metal aquecido, conforme a equação química a seguir.
4 Na + 3 CO2 → 2 Na2CO3 + C
Assinale a afirmação correta sobre essa reação e as substâncias nela envolvidas.
a) Essa é uma reação de auto-oxirredução.
b) Na reação, os átomos de sódio sofrem oxidação, enquanto a totalidade dos átomos de oxigênio sofre redução.
c) No sódio metálico, os átomos de sódio apresentam estado de oxidação + 1.
d) Na reação, a totalidade dos átomos de carbono sofre redução.
e) Os átomos de carbono presentes no CO2 apresentam o mesmo estado de oxidação que os átomos de carbono presentes no Na2CO3.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com atividades de química sobre Oxirredução:
01. b;
02. a;
03. b;
04. c;
05. a;
06. e;
07. d;
08. b;
09. e;
10. e
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
