Questão 01 sobre Mol: (Unifor CE/2008/Janeiro).
Considere a reação representada por:
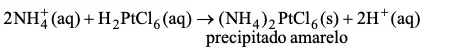
Esse precipitado amarelo, quando aquecido, libera cloro, Cl2 (g), amônia, NH3 (g) e HCl (g) (esses últimos podem produzir NH4Cl (s)), restando Pt(s) como resíduo. Na decomposição total de 1 mol de (NH4)2PtCl6 (s) a quantidade, em mols, de cloro (g), amônia (g) e cloreto de hidrogênio (g) é, respectivamente, igual a
a) 2, 2 e 2.
b) 2, 2 e 1.
c) 2, 1 e 2.
d) 1, 3 e 2.
e) 1, 2 e 3.
Questão 02. (Ufscar SP/2007/1ªFase). A azia é muitas vezes devida a uma alteração no pH do estômago, causada por excesso de ácido clorídrico. Antiácidos como o leite de magnésia neutralizam este ácido. O leite de magnésia apresenta em sua composição 64,8 g de hidróxido de magnésio, Mg(OH)2, por litro da suspensão. A quantidade de ácido que será neutralizada se uma pessoa ingerir duas colheres de sopa (volume total de 9 mL) de leite de magnésia é:
a) 0,02 mols.
b) 20 mols.
c) 200 mols.
d) 0,01 mols.
e) 0,58 mols.
Questão 03 sobre Mol: (Uftm MG/2007/1ªFase) Em um laboratório de química, amostras de metais de alta pureza, rotuladas com os números I, II, III e IV foram submetidas a testes químicos e físicos para sua identificação. Sabe-se que as amostras são de alumínio, cobre, magnésio e zinco, não necessariamente nessa ordem.
TESTE 1: determinação da densidade a 20 ºC
A massa da amostra II (10,80 g) foi determinada em uma balança semi-analítica e o seu volume foi determinado por meio do deslocamento de água destilada em uma proveta de 22,5 mL para 26,5 mL.
Dados de densidade a 20 ºC
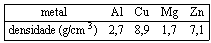
TESTE 2: Reação com solução de HCl
Foram testadas as amostras III e IV. A amostra III não reagiu no teste, enquanto que 9,72 g de amostra IV reagiram completamente com excesso de solução de HCl, produzindo 0,40 mol de gás hidrogênio.
A partir dos resultados, pode-se afirmar que as amostras I e IV referem-se, respectivamente, às amostras dos metais
a) alumínio e cobre.
b) alumínio e magnésio.
c) cobre e alumínio.
d) magnésio e zinco.
e) zinco e magnésio.
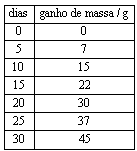
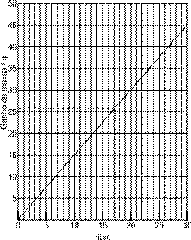
Questão 04. (Fuvest SP/2007/2ªFase) Um determinado agente antimofo consiste em um pote com tampa perfurada, contendo 80 g de cloreto de cálcio anidro que, ao absorver água, se transforma em cloreto de cálcio diidratado ![]() . Em uma experiência, o agente foi mantido durante um mês em ambiente úmido. A cada 5 dias, o pote foi pesado e registrado o ganho de massa:
. Em uma experiência, o agente foi mantido durante um mês em ambiente úmido. A cada 5 dias, o pote foi pesado e registrado o ganho de massa:
Dados:
massas molares (g / mol)
água…………………. 18
cloreto de cálcio….111
a) Construa, na folha de respostas ao lado, o gráfico que representa o ganho de massa versus o número de dias.
b) Qual o ganho de massa quando todo o cloreto de cálcio, contido no pote, tiver se transformado em cloreto de cálcio diidratado? Mostre os cálculos.
c) A quantos dias corresponde o ganho de massa calculado no item anterior? Indique no gráfico, utilizando linhas de chamada.

Questão 05 sobre Mol: (ITA SP/2007) Uma amostra de 1,222 g de cloreto de bário hidratado (BaCl2 . nH2O) é aquecida até a eliminação total da água de hidratação, resultando em uma massa de 1,042 g.
Com base nas informações fornecidas e mostrando os cálculos efetuados, determine:
a) o número de mols de cloreto de bário,
b) o número de mols de água e
c) a fórmula molecular do sal hidratado.
Questão 06. (Ufla MG/2006/1ªFase) Compostos de sal e água combinados em proporções definidas são chamadas hidratos e a água a eles associada é água de hidratação. 2,7 g do hidrato FeCl3 . XH2O fornecem, por aquecimento, 1,62 g de FeCl3 anidro.
O número de águas de hidratação do hidrato é:
a) 2
b) 6
c) 1
d) 3
e) 5
Questão 07. (Uerj RJ/2006/2ªFase) As máscaras de respiração, utilizadas por bombeiros em situações de emergência, contêm superóxido de potássio.
Essa substância reage com a umidade do ar expirado pelo usuário da máscara, conforme a equação abaixo.
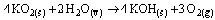
a) Considere as seguintes condições de uso de uma dessas máscaras:
– comportamento ideal dos gases e vapores envolvidos;
– funcionamento em sistema fechado, ou seja, sem trocas gasosas com a atmosfera;
– volume de ar respirado igual a 41,0 L por minuto;
– concentração de umidade no ar expirado igual a 6,2% volume por volume, a 37ºC e 1 atm de pressão;
– consumo total da umidade contida no ar expirado.
Calcule o tempo máximo de uso, em minutos, de uma máscara que contenha 213g de superóxido de potássio.
b) Além do superóxido de potássio, o potássio forma dois outros compostos binários oxigenados que não satisfazem os requisitos para uso em máscaras.
Indique as fórmulas desses compostos.
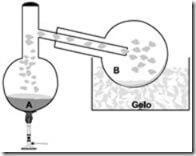
Questão 08 sobre Mol: (Ufmg MG/2006/2ªFase) Um estudante misturou 3,32 g de iodeto de potássio, KI (s), e quantidades estequiométricas de solução de ácido sulfúrico, H2SO4 (aq), de concentração 0,1 mol / L, e de dióxido de manganês, MnO2 (s), no balão A. Sob aquecimento, a mistura reagiu e produziu iodo molecular, I2. O iodo produzido sublimou e foi condensado, no balão B, por resfriamento.
1. ESCREVA osdesta equação balanceada da reação de formação de I2:
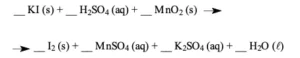
2. CALCULE a quantidade máxima de I2, em mol, que pode ser produzida nas condições descritas acima.
(Deixe seus cálculos registrados, explicitando, assim, seu raciocínio.)
3. Ao balão B, onde se condensou o iodo, I2 (s), adicionou-se uma solução de iodeto de potássio, KI (aq), que solubilizou o iodo sólido, I2 (s). O processo de dissolução do iodo sólido, I2 (s), em solução de iodeto de potássio, KI (aq), pode ser representado por estas equações de equilíbrio:
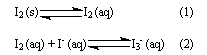
I2 é uma substância pouco solúvel em água, mas a formação do complexo ![]() , na solução, aumenta a solubilidade dessa substância.
, na solução, aumenta a solubilidade dessa substância.
Com base nas interações intermoleculares, JUSTIFIQUE por que o íon ![]() é mais solúvel em água do que o I2.
é mais solúvel em água do que o I2.
Questão 09. (Puc PR/2006) O óxido de magnésio é indicado como alternativa para diminuir a liberação de SO2 para a atmosfera. O referido fenômeno pode ser traduzido por meio da equação (não-balanceada) abaixo:
MgO(s) + SO2(g) + O2(g) MgSO4(s)
A respeito do fenômeno são feitas a seguintes afirmativas:
I. O produto deve conduzir a corrente elétrica quando dissolvido em água ou após fusão.
II. Para cada mol de SO2 são necessários 2 mols do MgO.
III. O MgO é um óxido básico enquanto o SO2 é um óxido ácido.
IV. Para tratar 1 tonelada de SO2 é necessário 1tonelada de MgO.
V. Ao final do processo, encontraremos uma substância composta de elevado ponto de ebulição.
São verdadeiras:
a) apenas IV e V.
b) I, II e V.
c) II, III e IV.
d) I, III e V.
e) II, III e IV.
Questão 10 sobre Mol: (Uepg PR/2005/Julho) Um método para a preparação controlada de oxigênio puro é a decomposição térmica de permanganato de potássio sob vácuo, conforme a equação:
2KMnO4(s) ® K2MnO4 (s) + MnO2 (s) + O2 (g)
Dados: K=39; Mn=55; O=16
Considere a decomposição completa de 2 mols de permanganato de potássio e assinale o que for correto.
01. A massa de KMnO4 (s) decomposta é 158 g.
02. A massa total dos produtos sólidos é 316 g.
04. A quantidade de O2 (g) produzida é 1 mol.
08. As quantidades, em mol, do reagente e de cada um dos produtos são iguais.
16. Nesta reação, ocorre redução dos átomos de manganês.
Confira nossas outras listas de exercícios sobre os cálculos estequiométricos:
- Exercícios sobre Mol e Cálculos Estequiométricos;
- Simulado sobre Cálculos Estequiométricos e Excessos;
- Exercícios Excessos e Cálculos Estequiométricos;
- Questões de química sobre Cálculos Estequiométricos.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre Mol e Cálculos Estequiométricos:
Resposta da Questão 01: A
Resposta da Questão 02: A
Resposta da Questão 03: E
Resposta da Questão 04:
a)
b) Cálculo do ganho de massa (massa d’água absorvida) pelo cloreto de cálcio:
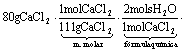
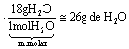
c) O ganho de massa de 26 g ocorre em 17 dias, aproximadamente (vide gráfico da alternativa a).
Resposta da Questão 05:
a) 0,005mol BaCl2
b) 0,01 mol H2O
c) BaCl2 . 2 H2O
Resposta da Questão 06: B
Resposta da Questão 07:
a) 15 minutos
b) K2O2; K2O
Resposta da Questão 08:
1. 1;2;1 -> 1;1;1;2
2. 0,01 mol
3. Porque as forças de interação eletrostática existentes entre o ![]() e a água são mais intensos quando comparadas com as forças existentes entre a água e o I2.
e a água são mais intensos quando comparadas com as forças existentes entre a água e o I2.
Obs.: A geometria mais estável para o ![]() é a geometria plana linear. E assim, o
é a geometria plana linear. E assim, o ![]() também seria apolar, o que dificultaria a sai dissolução em água.
também seria apolar, o que dificultaria a sai dissolução em água.
Resposta da Questão 09: D;
Resposta da Questão 10: 20;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
