Questão 01 sobre Estudo dos Gases Exercícios: Modelo Enem. Um vendedor de balões de gás na Praia de Boa Viagem, em Recife, utiliza um cilindro de 60L de Hélio a 5 atm de pressão, para encher os balões. A temperatura do ar é 3ºC e o cilindro está em um local bem ventilado na sombra.
ATENÇÃO!!! O Gabarito encontra-se no final da página!!!
No momento em que o vendedor não conseguir mais encher nenhum balão, qual o volume e a pressão do gás Hélio restante no cilindro?
a) V = 0 L; P = 0 atm
b) V = 22,4 L; P = 1 atm
c) V = 60 L; P = 1 atm
d) V = 10 L; P = 5 atm
e) V = 60 L e P = 0 atm
Questão 02. Modelo Enem. Ao subir do fundo de um lago para a superfície, o volume de uma bolha triplica. Supondo que a temperatura da água no fundo do lago seja igual à temperatura na superfície, e considerando que a pressão exercida por uma coluna de água de 10 m de altura corresponde, praticamente, à pressão de uma atmosfera, podemos concluir que a profundidade do lago é, aproximadamente.
a) 2 m.
b) 5 m.
c) 10 m.
d) 20 m.
e) 30 m.
Questão 03. Modelo Enem. Uma estudante está interessada em verificar as propriedades do hidrogênio gasoso a baixas temperaturas. Ela utilizou, inicialmente, um volume de 2,98 L de H2(g), à temperatura ambiente (25°C) e 1atm de pressão, e resfriou o gás, à pressão constante, a uma temperatura de – 200°C. Que volume desse gás a estudante encontrou no final do experimento?
a) 0,73 mL.
b) 7,30 mL.
c) 73,0 mL.
d) 730 mL.
e) 7300 mL.
Questão 04 sobre Estudo dos Gases Exercícios: Modelo Enem. Imediatamente acima da superfície da Terra localiza-se uma região da atmosfera conhecida como troposfera, na qual ocorrem as nuvens, os ventos e a chuva. A temperatura no seu topo é de –50oC e sua pressão é de 0,25 atm. Se um balão resistente a altas pressões, cheio com gás hélio até um volume de 10 litros, a 1,00 atm e 27oC for solto, qual o volume, em mL, deste balão quando chegar ao topo da troposfera?
Questão 05. Modelo Enem. A pressão total do ar no interior de um pneu era de 2,30 atm quando a temperatura do pneu era de 27 °C. Depois de ter rodado um certo tempo, mediu-se novamente sua pressão e verificou-se que esta era agora de 2,53 atm.
Supondo a variação de volume do pneu desprezível, a nova temperatura será:
a) 29,7 °C.
b) 57,0 °C.
c) 33,0 °C.
d) 330 °C.
e) n.d.a.
Questão 06. Modelo Enem. Um cilindro de gás industrial com capacidade para 100L, contém 44 Kg de gás propano a 27°C. Considerando que em uma semana seja consumido gás suficiente para que a pressão seja reduzida à metade e supondo que a temperatura permaneça constante, a pressão inicial no cilindro e número de mols de gás utilizado serão respectivamente: (Dado: C=12 g/mol, H=1 g/mol)
a) 246 atm e 500 mols
b) 246 atm e 22 mols
c) 123 atm e 1000 mols
d) 123 atm e 500 mols
e) 123 atm e 44 mols
Questão 07. Modelo Enem. A massa de oxigênio necessária para encher um cilindro de capacidade igual a 25 litros, sob pressão de 10 atm e a 25 °C é de: (Dados: massa molar do O2 = 32 g/mol; volume molar de gás a 1 atm e 25 °C = 25 L/mol)
a) 960 g.
b) 320 g.
c) 48 g.
d) 32 g.
e) 16 g.
Questão 08 sobre Estudo dos Gases Exercícios: Modelo Enem. Um tanque, contendo gás butano a 227°C com capacidade de 4,10 m3, sofre um vazamento ocasionado por defeito em uma das válvulas de segurança. Procedimentos posteriores confirmaram uma variação de pressão na ordem de 1,5 atm. Admitindo-se que a temperatura do tanque não variou, pode-se afirmar que a massa perdida de butano, em kg, foi: (Dados: C = 12 u; H = 1 u; R = 0,082 atm x L / mol x K.)
a) 8,7 kg.
b) 2,9 kg.
c) 15,0 kg.
d) 0,33 kg.
e) 30,3 kg.
Questão 09. Modelo Enem. Considere um balão de aniversário contendo 2,3 L de ar seco. Aproximadamente 20% deste gás são constituídos por oxigênio (O2). Suponha que 1 mol de gás ocupa aproximadamente um volume de 23 L, a 25 °C e sob a pressão de 1 atm.
O número aproximado de moléculas de oxigênio presentes no balão será:
a) 6,0 · 1022 moléculas.
b) 6,0 · 1023 moléculas.
c) 1,2 · 1022 moléculas.
d) 23 moléculas.
e) 0,46 moléculas.
Questão 10. Modelo Enem. É possível fazer um vulcão, em miniatura, no laboratório, usando o dicromato de amônio (NH4)2Cr2O7. Este composto, ao ser aquecido, se decompõe vigorosamente, liberando, dentre outras substâncias, os gases N2 e H2O. Se utilizarmos 25,2 g de dicromato de amônio e se forem recolhidos os gases de reação num balão de 2,0 L a 27 °C, a pressão total do gás, neste balão, em atmosferas, será igual a: (Dados: massas atômicas: H = 1 u; N = 14 u; O = 16 u; Cr = 52 u; R = 0,082 atm L K–1 mol–1)
(NH4)2Cr2O7(s) ĺ N2(g) + 4 H2O(g) + Cr2O3(s)
a) 0,11
b) 1,00
c) 1,11
d) 1,23
e) 12,3
Questão 11. Modelo Enem. Um frasco completamente vazio tem massa 820g e cheio de oxigênio tem massa 844g. A capacidade do frasco, sabendo-se que o oxigênio se encontra nas CNTP, é: Dados: massa molar do O2 = 32 g/mol; volume molar dos gases nas CNTP = 22,4 L.
a) 16,8 L.
b) 18,3 L.
c) 33,6 L.
d) 36,6 L.
e) 54,1 L.
Questão 12 sobre Estudo dos Gases Exercícios: Modelo Enem. Considere o diagrama:
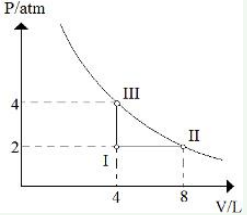
Qual o nome das transformações gasosas verificadas quando passamos de I para II, de II para III e de III para I respectivamente:
a) isobárica, isotérmica, isocórica
b) isocórica, isobárica, isotérmica
c) isobárica, isocórica, isotérmica
d) isotérmica, isobárica, isocórica
e) isotérmica, isocórica, isobárica
Questão 13. Modelo Enem. Em hospitais, o gás oxigênio (O2) é usado em algumas terapias do aparelho respiratório. Nesses casos, ele é armazenado em cilindros com volume de 60 L, a uma pressão de 150 atm. Considerando a temperatura constante, qual volume ocuparia o oxigênio contido em 1 cilindro, a uma pressão de 760 mm Hg?
a)7000L
b)8000L
c)9000L
d)1 0000L
e)6000L
Não deixe de conferir a primeira parte desta lista de exercícios sobre o estudo dos gases:
- Parte 01 – Questões sobre o estudo dos gases;
Simulado sobre o que são Biomoléculas; - Exercícios sobre Bioenergética com Gabarito;
- Exercícios sobre Atividade Enzimática;
>>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com exercícios sobre o Estudo dos Gases Exercícios com gabarito:
Resposta do exercício 01. c;
Resposta do exercício 02. d;
Resposta do exercício 03. d;
Resposta do exercício 04. d;
Resposta do exercício 05. b;
Resposta do exercício 06. a;
Resposta do exercício 07. b;
Resposta do exercício 08. a;
Resposta do exercício 09. c;
Resposta do exercício 10. d;
Resposta do exercício 11. a;
Resposta do exercício 12. a;
Resposta do exercício 13. c
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína

vc teria a resolução das questões ? não adiantar muito o gabarito sem resolução
O gabarito está ao final da página.