Questão 01 sobre Volume, Temperatura e Transformações dos Gases: O estudo das propriedades macroscópicas dos gases permitiu o desenvolvimento da teoria cinético-molecular, que explica, em nível microscópico, o comportamento dos gases. A respeito dessa teoria, são feitas as seguintes afirmações.
I. O comportamento dos gases está relacionado ao movimento uniforme e ordenado de suas moléculas.
II. A temperatura de um gás é uma medida da energia cinética de suas moléculas.
III. Os gases ideais não existem, pois são apenas modelos teóricos em que o volume das moléculas e suas interações são desprezíveis.
IV. A pressão de um gás dentro de um recipiente está associada às colisões das moléculas do gás com as paredes do recipiente.
Entre elas é(são) CORRETA(S)
A) I e II.
B) apenas I.
C) apenas IV.
D) III e IV.
Questão 02. Certa massa gasosa ocupa um volume de 100 litros numa dada temperatura e pressão. Qual o volume ocupado por essa mesma massa gasosa quando a pressão se reduzir de 2/7 da inicial, e a temperatura absoluta se reduzir a 5/7 da inicial?
Questão 03. (UFU-MG) Em relação aos gases, é INCORRETO afirmar que:
A) o volume do gás diminui com o aumento da temperatura, mantendo-se a pressão constante.
B) exercem pressão sobre as paredes do recipiente onde estão contidos.
C) a pressão aumenta com o aumento da temperatura, se o gás estiver fechado em um recipiente rígido.
D) difundem-se rapidamente uns nos outros.
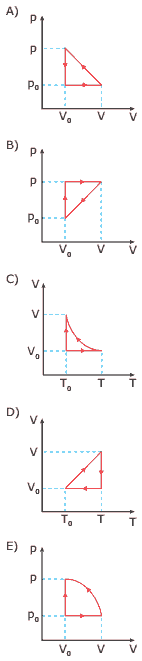
Questão 04 sobre Volume, Temperatura e Transformações dos Gases: (CEFET-MG–2007) Um gás ideal passa pelas seguintes transformações:
• Aumento do volume isobaricamente;
• Redução do volume ao valor inicial isotermicamente;
• Redução da temperatura ao valor inicial isovolumetricamente.
O gráfico que representa essas transformações é:
Questão 05. (EFOA-MG–2006) Recentemente, três brasileiros atingiram o cume do Monte Everest. Todos usavam um suprimento extra de oxigênio. Se, durante a escalada, um deles tivesse enchido um balão flexível com uma certa quantidade de O2, a uma temperatura de –48 ºC (225 K), a uma pressão de 30 kPa, e o balão atingisse um volume de 2,5 L, o volume do mesmo balão, contendo a mesma quantidade de oxigênio, próximo ao nível do mar, a 100 kPa e a 27 ºC (300 K), seria:
A) 2,5 L.
B) 1,0 L.
C) 2,24 L.
D) 11,1 L.
E) 0,42 L.
Questão 06. (UFAL–2010) O gráfico a seguir ilustra o comportamento referente à variação de pressão versus volume, de um gás ideal, à temperatura constante. Sobre este sistema, analise o gráfico e assinale a alternativa CORRETA.
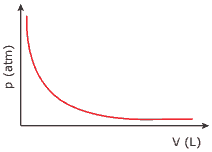
A) Ao comprimir o gás a um volume correspondente à metade do volume inicial, a pressão diminuirá por igual fator.
B) Ao diminuir a pressão para um valor correspondente a 1/3 da pressão inicial, o volume diminuirá pelo mesmo fator.
C) Quando a pressão triplica, o produto pV aumenta por igual fator.
D) Quando o gás é comprimido nessas condições, o produto da pressão pelo volume permanece constante.
E) O volume do gás duplicará quando a pressão final for o dobro da pressão inicial.
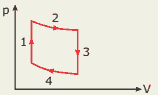
Questão 07 sobre Volume, Temperatura e Transformações dos Gases: (UFG–2008) O motor de Stirling é um sistema que regenera o ar quente em um ciclo fechado. As transformações que ocorrem nesse motor podem ser representadas, idealmente, pelas seguintes etapas:
1. O gás é aquecido a volume constante.
2. O gás se expande a uma temperatura constante.
3. O gás é resfriado a volume constante.
4. O gás se contrai a uma temperatura constante.
FAÇA o diagrama pressão x volume para essas etapas do motor de Stirling.
Questão 08. (UFLA-MG) Um recipiente de 4,0 litros contém um gás ideal, a uma pressão de 2,0 atm. Qual o valor da pressão que esse gás exercerá quando o volume do recipiente for reduzido para 0,5 litro, à temperatura constante?
A) p = 4,0 atm
B) p = 0,25 atm
C) p = 1,0 atm
D) p = 16,0 atm
E) p = 2,0 atm
Questão 09. (UFLA-MG) Um gás que apresenta comportamento ideal a 273 ºC e 380 mmHg ocupa um volume de 292 mL. Que volume o mesmo gás ocupará nas CNTP?
A) 146 mL
B) 20 mL
C) 73 mL
D) 150 mL
E) 98 mL
Questão 10 sobre Volume, Temperatura e Transformações dos Gases: (UFJF-MG–2007) A calibração dos pneus de um automóvel deve ser feita periodicamente. Sabe-se que o pneu deve ser calibrado a uma pressão de 30 lb/pol2 em um dia quente, a uma temperatura de 27 ºC. Supondo que o volume e o número de mols injetados são os mesmos, qual será a pressão de calibração (em atm) nos dias mais frios, em que a temperatura atinge 12 ºC?
Dado: Considere 1 atm = 15 lb/pol2
A) 1,90 atm
B) 2,11 atm
C) 4,50 atm
D) 0,89 atm
E) 14,3 atm
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre Volume, Temperatura e Transformações dos Gases:
01. D;
02. 100 litros;
03. A;
04. D;
05. B ;
06. D;
07. 
08. D;
09. C;
10. A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
