Questão 01 sobre Solubilidade Química: (PUC Minas–2009) O gráfico representa as curvas de solubilidade de alguns sais em água.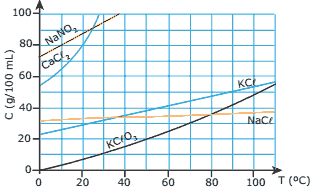
De acordo com o gráfico, podemos concluir que:
A) a substância mais solúvel em água, a 40 ºC, é o nitrito de sódio.
B) a temperatura não afeta a solubilidade do cloreto de sódio.
C) o cloreto de potássio é mais solúvel que o cloreto de sódio à temperatura ambiente.
D) a massa de clorato de potássio capaz de saturar 200 mL de água, a 30 ºC, é de 20 g.
Questão 02. (UFPI) Em regiões mais áridas do Nordeste, os pescadores preferem os horários mais frios do dia para pescar. De fato, nesses períodos, a pesca é mais farta, porque os peixes vão à superfície em busca de oxigênio (O2).
A maior concentração de O2 na superfície, nos períodos mais frios, explica-se pelo fato de a:
A) redução na temperatura aumentar a solubilidade de gases em líquidos.
B) redução na temperatura aumentar a constante de dissociação da água.
C) elevação no número de moles de O2 ocorrer com a redução da pressão.
D) solubilidade de gases em líquidos independer da pressão.
E) elevação na temperatura reduzir a energia de ativação da reação de redução do oxigênio.
Questão 03 sobre Solubilidade Química: (FMTM-MG) A tabela apresenta a solubilidade do KNO3 e do CsNO3 em água.
| Temperatura | g KNO3/100 g H2O | g CsNO3/100 g H2O |
| 20 ºC | 31,6 | 23,0 |
| 70 ºC | 138,0 | 107,0 |
Em 100 g de uma amostra contendo partes iguais de KNO3 e de CsNO3, foram adicionados 50 g de água a 70 ºC. Após resfriamento até 20 ºC, coletou-se o sólido cristalizado. Considerando-se que a solubilidade de um sal não é afetada pela presença de outro sal, pode-se afirmar que se cristalizaram:
A) 18,4 g de KNO3 e 27,0 g de CsNO3.
B) 34,2 g de KNO3 e 38,5 g de CsNO3.
C) 53,2 g de KNO3 e 42,0 g de CsNO3.
D) 68,4 g de KNO3 e 77,0 g de CsNO3.
E) 106,4 g de KNO3 e 84,0 g de CsNO3.
Questão 04. (FUVEST-SP) Quatro tubos contêm 20 mL (mililitros) de água cada um. Coloca-se, nesses tubos, dicromato de potássio (K2Cr2O7) nas seguintes quantidades:
| Massa de K 2Cr2O7 / g | |
| Tubo A | 1,0 |
| Tubo B | 3,0 |
| Tubo C | 5,0 |
| Tubo D | 7,0 |
A solubilidade do sal, a 20 ºC, é igual a 12,5 g por 100 mL de água. Após agitação, em quais dos tubos coexistem, nessa temperatura, solução saturada e fase sólida?
A) Em nenhum.
B) Apenas em D.
C) Apenas em C e D.
D) Apenas em B, C e D.
E) Em todos.
Questão 05 sobre Solubilidade Química: (FTB-DF) O gráfico a seguir representa as curvas de solubilidade de várias substâncias.
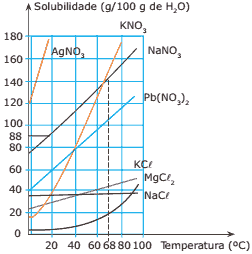
Com base no gráfico, é CORRETO afirmar que:
A) a 0 ºC o KCl é menos solúvel em água que o KNO3.
B) o KCl e o NaCl apresentam sempre a mesma solubilidade em qualquer temperatura.
C) a solubilidade de todos os sais representados no gráfico aumenta com a elevação da temperatura.
D) a entalpia de solubilização do KCl é negativa, ou seja, a dissolução de KCl é exotérmica.
E) a 20 ºC o MgCl2 apresenta a maior solubilidade entre todos os sais representados no gráfico.
Questão 06. (UFV-MG–2007) A solubilidade do nitrato de potássio (KNO3), em função da temperatura, é representada no gráfico a seguir:
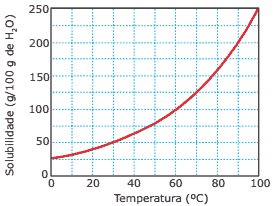
De acordo com o gráfico, assinale a alternativa que indica CORRETAMENTE a massa de KNO3, em gramas, presente em 750 g de solução, na temperatura de 30 ºC.
A) 250
B) 375
C) 150
D) 100
E) 500
Questão 07 sobre Solubilidade Química: (PUC Minas) Considere o gráfico de solubilidade de substâncias a seguir:
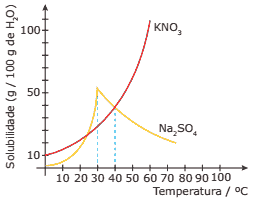
Assinale a afirmativa INCORRETA.
A) No intervalo de temperatura de 30 ºC a 100 ºC, há diminuição da solubilidade do Na2SO4.
B) Na temperatura de 40 ºC, o KNO3 apresenta a mesma solubilidade do Na2SO4.
C) Na temperatura de 20 ºC, o Na2SO4 é mais solúvel que o KNO3.
D) A solubilidade do KNO3 na temperatura de 0 ºC é igual a 10 g KNO3 / 100 g H2O.
Questão 08. (Fei-SP) A tabela a seguir fornece as solubilidades do KCl e do Li2CO3 a várias temperaturas.
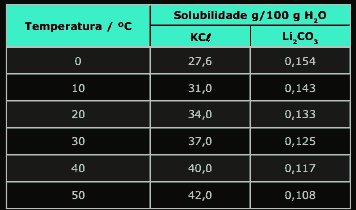
Assinale a alternativa INCORRETA.
A) A dissolução do KCl em água é endotérmica.
B) A massa de KCl capaz de saturar 50 g de água, a 40 ºC, é 20 g.
C) Ao se resfriar de 50 ºC até 20 ºC, uma solução que contém, inicialmente, 108 mg de Li2CO3 em 100g de água, haverá precipitação de 25 mg de Li2CO3.
D) A mistura formada pela adição de 154 mg de Li2CO3, em 100 g de H2O, a 0 ºC, é saturada.
E) A solubilidade de Li2CO3 aumenta com a diminuição da energia cinética média das moléculas do solvente.
Questão 09. (PUC Minas) A tabela a seguir fornece as solubilidades do KNO3 e do Ce2(SO4)3 a várias temperaturas.
| Temperatura (ºC) | Solubilidade do KNO3 (g/100 g H2O) | Solubilidade do Ce2(SO4)3 (g/100 g H2O) |
| 0 | 13,0 | 19,0 |
| 10 | 18,0 | 14,2 |
| 20 | 30,0 | 10,0 |
| 30 | 46,0 | 8,6 |
| 40 | 64,0 | 6,5 |
| 50 | 85,0 | 4,3 |
| 60 | 108,0 | 2,5 |
Assinale a afirmativa INCORRETA.
A) A dissolução do KNO3 em água é endotérmica.
B) O aquecimento diminui a solubilidade do Ce2(SO4)3 em água.
C) A massa de KNO3 capaz de saturar 50 g de água, a 20 ºC, é 60 g.
D) Uma solução saturada de KNO3, ao ser resfriada de 50 ºC para 20 ºC, produz depósito da ordem de 55 g.
E) A 10 ºC, a solubilidade do Ce2(SO4)3 é menor do que a do KNO3.
Questão 10 sobre Solubilidade Química: (UFSCar-SP–2006) As solubilidades dos sais KNO3 e Ce2(SO4)3, em água, medidas em duas temperaturas diferentes, são fornecidas na tabela a seguir:
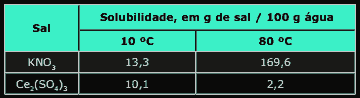
Com base nesses dados, pode-se afirmar que:
A) a dissolução de KNO3, em água, é um processo exotérmico.
B) a dissolução de Ce2(SO4)3, em água, é acompanhada de absorção de calor no ambiente.
C) os dois sais podem ser purificados pela dissolução de cada um deles em volumes adequados de água a 80 ºC, seguido do resfriamento de cada uma das soluções a 10 ºC.
D) se 110,1 g de uma solução saturada de Ce2(SO4)3 a 10 ºC forem aquecidos a 80 ºC, observa-se a deposição de 2,2 g do sal sólido.
E) a adição de 100 g de KNO3 a 100 g de água a 80 ºC dá origem a uma mistura homogênea.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de Química sobre Solubilidade Química:
01. D;
02. A;
03. B;
04. D;
05. D;
06. A;
07. C;
08. C;
09. C;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína

Não concordo com a resposta da questão 5
A questão 06, acredito que a resposta não é a letra A como informa o gabarito, mas sim a letra B
Conforme o gráfico, o KNO3 consegue solubilizar 50 g em 100 g de água.
50 g de KNO3 …………………….100 g de água
x g de KNO3 ……………………….750 g de água
x = 50 . 750 / 100
x = 37.500 / 100 –> 375 g de KN3