Questão 01 sobre Reações Exotérmicas e Endotérmicas: (UFMG) Uma certa quantidade de água é colocada em um congelador, cuja temperatura é de –20 ºC. Após estar formado e em equilíbrio térmico com o congelador, o gelo é transferido para outro congelador, cuja temperatura é de –5 ºC.
Considerando-se essa situação, é CORRETO afirmar que, do momento em que é transferido para o segundo congelador até atingir o equilíbrio térmico no novo ambiente, o gelo:
A) se funde.
B) transfere calor para o congelador.
C) se aquece.
D) permanece na mesma temperatura inicial.
Questão 02. (UERJ) As equações químicas a seguir representam reações de síntese, realizadas em diferentes condições, para a obtenção de uma substância hipotética XY.
I. X2(g) + Y2(g) → 2XY(l) + Q1
II. X 2(g) + Y2(g) → 2XY(s) + Q2
III. X 2(g) + Y2(g) → 2XY(g) + Q3
Considere Q1, Q2 e Q3 as quantidades de calor liberadas, respectivamente, nas reações I, II e III. A relação entre essas quantidades está expressa na seguinte alternativa:
A) Q1 > Q2 > Q3
B) Q2 > Q1 > Q3
C) Q3 > Q1 > Q2
D) Q3 > Q2 > Q1
Questão 03 sobre Reações Exotérmicas e Endotérmicas: (UFMG) Ao se sair molhado em local aberto, mesmo em dias quentes, sente-se uma sensação de frio. Esse fenômeno está relacionado com a evaporação da água que, no caso, está em contato com o corpo humano.
Essa sensação de frio explica-se CORRETAMENTE pelo fato de que a evaporação da água:
A) é um processo endotérmico e cede calor ao corpo.
B) é um processo endotérmico e retira calor do corpo.
C) é um processo exotérmico e cede calor ao corpo.
D) é um processo exotérmico e retira calor do corpo.
Questão 04. (UCB-DF) Numa sauna a vapor, o calor envolvido na condensação do vapor de água é, em parte, responsável pelo aquecimento da superfície da pele das pessoas que estão em seu interior, de acordo com o diagrama a seguir:
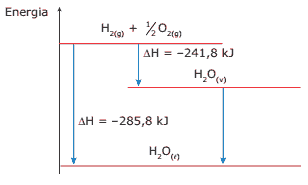
De acordo com as informações fornecidas, o que ocorrerá na transformação de 1 mol de água vaporizada em 1 mol de água líquida?
A) Liberação de 44 kJ
B) Absorção de 44 kJ
C) Liberação de 527,6 kJ
D) Absorção de 527,6 kJ
E) N.d.a
Questão 05 sobre Reações Exotérmicas e Endotérmicas: (UFMG–2010) Ao se preparar uma solução aquosa concentrada de sal de cozinha, NaCl, observou-se, durante a dissolução, um resfriamento do sistema. Considerando-se a situação descrita e outros conhecimentos sobre o assunto, é CORRETO afirmar que:
A) a dissolução do NaCl aumenta a energia cinética média das moléculas da água.
B) a quantidade de NaCl dissolvida determina o grau de resfriamento do sistema.
C) a quebra do retículo cristalino do NaCl é um processo exotérmico.
D) a solução transfere energia, na forma de calor, para a vizinhança.
Questão 06. (FCMSC-SP) Exemplifica um processo endotérmico:
A) a queima da parafina de uma vela.
B) a dissolução do ácido sulfúrico concentrado na água líquida.
C) a combustão do álcool hidratado em motores de automóveis.
D) a vaporização da água de uma piscina pela ação da luz solar.
E) a formação de um iceberg a partir da água do mar.
Questão 07 sobre Reações Exotérmicas e Endotérmicas: (UFJF-MG) Uma vela é feita de um material com a composição C20H42. A reação de combustão desse material pode ser representada pela equação química a seguir:
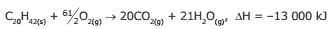
Considerando-se a quantidade de calor envolvida na combustão de 10,0 g dessa vela e a classificação da reação, pode-se afirmar que ocorre:
A) absorção de 461 kJ, e a reação é endotérmica.
B) liberação de 461 kJ, e a reação é exotérmica.
C) absorção de 13 000 kJ, e a reação é endotérmica.
D) liberação de 13 000 kJ, e a reação é exotérmica.
E) liberação de 461 kJ, e a reação é endotérmica.
Questão 08. (FCMMG–2009) Considere um experimento em que ocorre a dissolução de hidróxido de sódio em um béquer contendo água. O sistema, no início (tempo zero), é constituído por H2O(l) e por NaOH(s), ambos à temperatura ambiente.Nota-se, nos instantes iniciais do experimento, um aumento da temperatura da fase líquida. Com o decorrer do tempo, o equilíbrio térmico entre o sistema e a vizinhança é restabelecido e oexperimento é encerrado.
Com relação a esse experimento, a afirmativa INCORRETA é:
A) A dissolução do hidróxido de sódio sólido em água líquida é um processo exotérmico.
B) A temperatura aumenta, nos instantes iniciais, porque ocorre um fluxo de calor da vizinhança para o sistema.
C) Nos instantes iniciais do experimento, a energia cinética média das partículas constituintes do sistema aumenta.
D) No tempo zero, as energias cinéticas médias das partículas constituintes da água e do hidróxido de sódio são iguais.
Questão 09. (UFMG) Considere o seguinte diagrama de entalpia, envolvendo o dióxido de carbono e as substâncias elementares diamante, grafita e oxigênio.
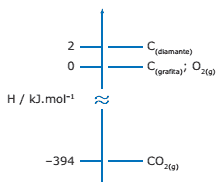
Considerando esse diagrama, assinale a afirmação FALSA.
A) A transformação do diamante em grafita é exotérmica.
B) A variação de entalpia na combustão de 1 mol de diamante é igual a –394 kJ.mol-1.
C) A variação de entalpia na obtenção de 1 mol de CO2(g), a partir da grafita, é igual a –394 kJ.mol-1.
D) A variação de entalpia na obtenção de 1 mol de diamante, a partir da grafita, é igual a 2 kJ.mol-1.
Questão 10 sobre Reações Exotérmicas e Endotérmicas: (PUC Minas) A 25 ºC e 1 atm de pressão, 1 mol de nitrogênio gasoso, reagindo com 1 mol de oxigênio gasoso, produz monóxido de nitrogênio gasoso com absorção de 22 kcal do produto obtido. O diagrama que representa CORRETAMENTE essa informação é :
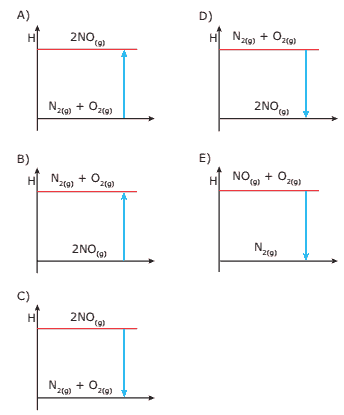
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre Reações Exotérmicas e Endotérmicas:
01. C;
02. B;
03. B;
04. A;
05. B;
06. D;
07. B;
08. B;
09. B;
10. A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
