Questão 01 sobre Dualidade Onda-partícula e Efeito Fotoelétrico: (UFMS–2007) O efeito fotoelétrico consiste na emissão de elétrons pela matéria sob a ação de fótons (luz). Os elétrons emitidos possuem variadas energias, sendo os mais energéticos aqueles que estavam menos ligados ao material. Considerando um feixe de luz coerente (única frequência), incidindo sobre a superfície de um material, e que esteja produzindo o efeito fotoelétrico, é CORRETO afirmar:
01. A energia máxima com a qual os elétrons são emitidos não depende da frequência do feixe de luz incidente.
02. Quanto maior a intensidade do feixe de luz incidente, maior a taxa de emissão de elétrons.
04. A energia de um feixe de luz não depende do comprimento de onda da luz.
08. A emissão de elétrons é explicada pela teoria ondulatória da luz.
16. Os elétrons são emitidos porque absorvem energia dos fótons durante a colisão.
Soma ( )
Questão 02. (UFC–2007) No início do século XX, novas teorias provocaram uma surpreendente revolução conceitual na Física. Um exemplo interessante dessas novas ideias está associado às teorias sobre a estrutura da matéria, mais especificamente àquelas que descrevem a estrutura dos átomos. Dois modelos atômicos propostos nos primeiros anos do século XX foram o de Thomson e o de Rutherford. Sobre esses modelos, assinale a alternativa CORRETA:
A) No modelo de Thomson, os elétrons estão localizados em uma pequena região central do átomo, denominada núcleo, e estão cercados por uma carga positiva, de igual intensidade, que está distribuída em torno do núcleo.
B) No modelo de Rutherford, os elétrons são localizados em uma pequena região central do átomo e estão cercados por uma carga positiva, de igual intensidade, que está distribuída em torno do núcleo.
C) No modelo de Thomson, a carga positiva do átomo encontra-se uniformemente distribuída em um volume esférico, ao passo que os elétrons estão localizados na superfície da esfera de carga positiva.
D) No modelo de Rutherford, os elétrons movem-se em torno da carga positiva, que está localizada em uma pequena região central do átomo, denominada núcleo.
E) O modelo de Thomson e o modelo de Rutherford consideram a quantização da energia.
Questão 03. (UFG–2006) Transições eletrônicas, em que fótons são absorvidos ou emitidos, são responsáveis por muitas das cores que percebemos. Na figura a seguir, vê-se parte do diagrama de energias do átomo de hidrogênio.
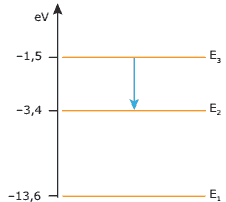
Na transição indicada (E3 → E2), um fóton de energia:
A) 1,9 eV é emitido.
B) 1,9 eV é absorvido.
C) 4,9 eV é emitido.
D) 4,9 eV é absorvido.
E) 3,4 eV é emitido.
Questão 04 sobre Dualidade Onda-partícula e Efeito Fotoelétrico: (UFMG) O átomo de hidrogênio é composto por um próton e um elétron. No estado fundamental, a energia de ligação entre eles é de –13,60 eV. A energia de ligação do primeiro estado excitado é –3,40 eV, e a do segundo é –1,50 eV, conforme representado na figura A. Considere que o elétron esteja no segundo estado excitado. Para decair para o estado fundamental, ele emitirá fótons. A figura B representa linhas de espectro de emissão do átomo de hidrogênio, com os respectivos valores de energia indicados. Quais linhas podem aparecer nesse decaimento?
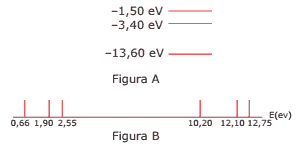
A) Somente as linhas com energia 12,10 eV, 10,20 eV e 1,90 eV
B) Somente a linha com energia 12,10 eV
C) Com exceção da linha de 12,75 eV, todas as demais
D) Somente a linha com energia 12,75 eV
E) Somente as linhas com energia 10,20 eV e 1,90 eV
Questão 05. (Unifor-CE–2007) Um elétron, no primeiro estado quântico do átomo de hidrogênio, possui velocidade igual a 2,0 x 106 m/s. A massa do elétron é 9,1 x 10–31 kg, e a constante de Planck é 6,6 x 10–34 J.s. O comprimento de onda de de Broglie desse elétron, em metros, vale:
A) 2 x 10-59.
B) 2,4 x 10-16.
C) 3,6 x 10-10.
D) 2,4 x 10-8.
E) 1,2 x 10-6.
Questão 06. (UEL-PR–2007) Atualmente, sabe-se que as partículas que compõem a matéria formadora do Universo podem ter comportamentos de natureza tanto corpuscular como ondulatória. O fato de não observarmos diretamente a natureza ondulatória em objetos materiais macroscópicos, como em uma bola de bilhar de aproximadamente 50 g, possuindo velocidade igual a 5,0 m/s, deve-se:
Dado: h = 6,63 x 10-34 J.s = 4,14 x 10-15 eV.s.
A) à razão de não ter sido inventado um aparelho óptico que identifique diretamente essa característica da matéria.
B) ao fato de o comprimento de onda associado, que tem o valor de 2,65 x 10-33 m, ser pequeno para uma detecção, mesmo com aparelhos de medida que alcancem a ordem de grandeza no nível subatômico.
C) à massa da bola, pois tem um valor muito grande para ser possível a demonstração do caráter ondulatório.
D) a uma falha dos postulados de Louis de Broglie e na experiência de Davisson-Germer na medida de comprimento de onda da bola de bilhar.
E) aos centros difratores (orifícios, fendas ou átomos) utilizados para medir a frequência da onda associada à bola, de valor 1,89 x 1033 Hz, estarem localizados incorretamente nos equipamentos de detecção.
Questão 07 sobre Dualidade Onda-partícula e Efeito Fotoelétrico: (UFT–2007) Em um átomo, o primeiro nível, ocupado por um elétron, tem energia E1 = −2,6 x 10-19 J e o segundo, desocupado, tem energia E2 = −1,3 x 10-19 J. Ao ser iluminado com luz monocromática, de determinada frequência, esse átomo absorve um fóton e, com isso, o elétron passa do primeiro nível para o segundo. Sabe-se que a constante de Planck é de 6,6 x 10-34 J.s. Considerando-se essas informações, é CORRETO afirmar que, na situação descrita, a frequência da luz incidente no átomo é de, aproximadamente:
A) 1 x 1014 s-1.
B) 2 x 1014 s-1.
C) 3 x 1014 s-1.
D) 4 x 1014 s-1.
Questão 08. (UFRN–2008) No início do século XX, foram propostos dois modelos atômicos da matéria segundo os quais o átomo era constituído de um pequeno núcleo formado por cargas positivas e, em torno desse núcleo, orbitavam os elétrons. O modelo de Rutherford (1911) baseava-se em experimentos de espalhamento de partículas alfa desviadas pelos núcleos atômicos, enquanto o modelo de Bohr (1913), que procurava superar as limitações do modelo anterior, explicava o espectro de linhas de emissão do átomo de hidrogênio supondo que os elétrons podiam realizar transições entre as órbitas eletrônicas. Em relação a um dos modelos anteriormente citados, pode-se afirmar também:
A) O modelo de Bohr explicava a estabilidade das órbitas eletrônicas do átomo a partir da quantização do momento angular.
B) O modelo de Bohr mostrava a instabilidade das órbitas eletrônicas do átomo a partir dos experimentos de espalhamento de partículas alfa.
C) O modelo de Rutherford explicava a instabilidade das órbitas eletrônicas do átomo a partir da quantização da energia.
D) O modelo de Rutherford mostrava a estabilidade das órbitas eletrônicas do átomo a partir de experimentos de espalhamento de partículas alfa.
Questão 09. (Unimontes-MG–2007) Em 1913, apenas dois anos após o físico inglês Ernest Rutherford ter mostrado que o átomo possuía um núcleo, o grande físico dinamarquês Niels Bohr propôs um modelo para o átomo de hidrogênio que não apenas levava em conta a existência das linhas espectrais, mas predizia seus comprimentos de onda com uma precisão em torno de 0,02%. Os postulados que Bohr introduziu para seu modelo são:
1. Um átomo pode existir, sem irradiar energia, em qualquer um de um conjunto discreto de estados de energia estacionários;
2. Um átomo pode emitir ou absorver radiação apenas durante transições entre esses estados estacionários.
A frequência da radiação e, consequentemente, da linha espectral correspondente é dada por h.fif = Ei – Ef (h é a constante de Planck, cujo valor é 4,14 x 10-15eV.s). Um átomo absorve um fóton de frequência 6,2 x 1014 Hz. Com base no modelo de Bohr, a energia do átomo aumenta de, aproximadamente:
A) 6,0 eV.
B) 5,2 eV.
C) 4,1 eV.
D) 2,6 eV.
Questão 10 sobre Dualidade Onda-partícula e Efeito Fotoelétrico: (Enem) Há exatos 100 anos, o físico Ernest Rutherford faria um anúncio que mudaria para sempre os rumos da ciência: o átomo tem uma região central, o núcleo, onde toda a sua carga positiva e praticamente toda sua massa está concentrada. Para descobrir isso, Rutherford lançou partículas alfa (dupla carga positiva) contra uma finíssima lâmina de ouro. Para perplexidade, Rutherford notou que algumas partículas eram desviadas e umas eram até mesmo ricocheteadas de volta. Ao final de 1910, Rutherford entendeu que o ricocheteio dessas partículas era o resultado de uma única interação (colisão) entre a partícula alfa e a carga positiva do núcleo atômico. Nesse novo modelo atômico, os elétrons orbitavam o núcleo, como um sistema planetário, em uma região esférica de raio comparável ao tamanho do átomo. No experimento de Rutherford, a chance de uma partícula alfa passar nas proximidades de um núcleo e sofrer desvio era bem pequena. Mais rara ainda, seria uma aproximação quase de frente contra o núcleo, com a consequente deflexão da partícula alfa em sentido contrário. Rutherford registrou um único desvio para trás em cada 20 mil partículas alfas lançadas contra o alvo.
CIÊNCIA HOJE. fev. 2011 (Adaptação).
De acordo com o seu experimento, Rutherford pôde concluir que o tamanho do núcleo atômico era:
A) muito grande, pois algumas partículas alfas incidentes foram refletidas pela lâmina de ouro.
B) muito grande, pois algumas partículas alfas foram desviadas pela lâmina de ouro.
E) igual ao próprio tamanho do átomo, pois a massa nuclear é praticamente igual à massa atômica.
D) ínfimo, pois pouquíssimas partículas alfas incidentes foram refletidas de volta pela lâmina de ouro.
E) ínfimo, pois muitas partículas alfas incidentes foram refletidas de volta pela lâmina de ouro.
🔵 >>> Verifique todos os nossos exercícios e atividades de Física.
Gabarito com as respostas dos 10 exercícios de Física sobre Dualidade Onda-partícula e Efeito Fotoelétrico:
01. Resultado = 18;
02. D;
03. A;
04. A;
05. C;
06. B;
07. B;
08. A;
09. D;
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
