Questão 01 sobre Energia de Ligação Química: (UFRGS) A seguir, é apresentado um quadro com algumas energias de ligação no estado gasoso:Ligação ∆H (kcal.mol-1) H–H 470,7 Cl–Cl 242,5 O=O 489,2 N≡N 940,8 H–Cl 431,5 H–Br 365,9 H–I 298,6
São feitas as seguintes afirmações:
I. É preciso mais energia para decompor a molécula de oxigênio do que para decompor a molécula de nitrogênio.
II. A molécula de HCl deve ser mais estável do que as moléculas de HBr e HI.
III. Entre as moléculas gasosas H2, O2 e Cl2, a molécula de Cl2 é a menos estável.
IV. A reação H2(g) + Cl2(g) → 2HCl(g) deve ser endotérmica.
Quais estão CORRETAS?
A) Apenas I e II.
B) Apenas I e III.
C) Apenas II e III.
D) Apenas I, III e IV.
E) Apenas II, III e IV.
Questão 02. (ITA-SP) Assinale qual das reações a seguir é a mais endoenergética:
A) B2(g) → 2B(g)
B) C2(g) → 2C(g)
C) N2(g) → 2N(g)
D) O2(g) → 2O(g)
E) F2(g) → 2F(g)
Questão 03 sobre Energia de Ligação Química: (UFOP-MG–2008) O ácido clorídrico é um importante ácido industrial, e uma das etapas de sua obtenção é representada pela seguinte equação química:
H2(g) + Cl2(g) → 2HCl(g)
Considere a seguinte tabela de valores de energia de ligação:
| Substância | Energia de ligação / kJ.mol-1 |
| H 2(g) | 436,0 |
| Cl 2(g) | 243,0 |
| HCl (g) | 432,0 |
Com base nessa tabela, pode-se afirmar que a entalpia de formação do HCl(g), em kJ.mol-1, é de:
A) 247,0.
B) 123,0.
C) –247,0.
D) –92,5.
Questão 04. (UEG-GO–2007)
| Ligação | Entalpia de ligação / kJ.mol-1 |
| C–C | 348 |
| C–H | 412 |
| C=O | 743 |
| O=O | 484 |
| O–H | 463 |
Baseado na tabela anterior contendo valores de entalpias de ligação, o calor liberado em kJ.mol-1, na reação de combustão completa do butano em fase gasosa, seria:
A) 1 970.
B) 2 264.
C) 4 180.
D) 5 410.
Questão 05 sobre Energia de Ligação Química: (UNIFESP) Com base nos dados da tabela:
| Ligação | Energia média de ligação (kJ.mol-1) |
| O–H | 460 |
| H–H | 436 |
| O=O | 490 |
pode-se estimar que o ∆H da reação representada por 2H2O(g) → 2H2(g) + O2(g), dado em kJ por mol de H2O(g), é igual a:
A) +239.
B) +478.
C) +1 101.
D) –239.
E) –478.
Questão 06. (UFRGS) Considere as energias de ligação, em kJ.mol-1, listadas na tabela a seguir:
| Ligação | Energia (kJ.mol-1) |
| C–C | 347 |
| C=C | 611 |
| C–H | 414 |
| Br–Br | 192 |
| H–Br | 368 |
| C–Br | 284 |
O valor de ∆Hº, em kJ.mol-1, para a reação CH3CH== CH2 + Br2 → CH3CHBrCH2Br é igual a:
A) –235.
B) –112.
C) zero.
D) +112.
E) +235.
Energia de Ligação Química: (FGV-SP–2008)
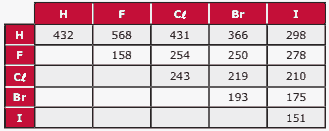
Instrução: Na tabela, são dadas as energias de ligação (kJ/mol) a 25 ºC para algumas ligações simples, para moléculas diatômicas entre H e os halogênios (X). Observe-a e responda às questões 07 e 08.
Questão 07 sobre Energia de Ligação Química: Modelo Enem. Analise as afirmações seguintes.
I. Entre os compostos HX, o HF é o ácido mais fraco e a sua ligação H—F é a mais forte.
II. A distância de ligação entre os átomos nas moléculas X2 é maior no I2, já que a sua energia de ligação é a mais fraca.
III. A molécula com maior momento dipolar é o HI.
Está CORRETO o contido em:
A) I, II e III.
B) I e II, apenas.
C) I e III, apenas.
D) II e III, apenas.
E) II, apenas.
Questão 08. Modelo Enem. O cloreto de hidrogênio é um gás que, quando borbulhado em água, resulta em uma solução de ácido clorídrico. Esse composto é um dos ácidos mais utilizados nas indústrias e laboratórios químicos. A energia para formação de 2 mol de cloreto de hidrogênio, em kJ, a partir de seus elementos, é igual a:
A) +862.
B) +187.
C) –187.
D) –244.
E) –862.
Questão 09. (UFTM-MG) O fósforo branco e o fósforo vermelho são alótropos do elemento fósforo. O arranjo estrutural dessas moléculas é tetraédrico, com átomos de P em cada vértice. A energia de dissociação do fósforo branco, P4, é 1 260 kJ.mol-1. O valor médio previsto para a energia de ligação P—P no fósforo branco é, em kJ.mol-1:
fósforo branco (P4)
A) 210.
B) 252.
C) 315.
D) 420.
E) 630.
Questão 10 sobre Energia de Ligação Química: (UFTM-MG) Utilizando os valores médios de energia de ligação (variação de energia quando 1,0 mol de ligações é quebrado no estado gasoso a 25 ºC e 1 atm) em kJ/mol (H—H: 436; O=O: 496; e O—H: 463) e a entalpia de vaporização de H2O a 25 ºC igual a 44 kJ/mol, a entalpia de formação da água no estado líquido, em kJ/mol, é:
A) +286.
B) +242.
C) +198.
D) –242.
E) –286.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões de química sobre Energia de Ligação Química:
01. C;
02. C;
03. D;
04. B;
05. A;
06. B;
07. B;
08. C;
09. A;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
