Questão 01 sobre Teoria Atômico Molecular: (PUC-Rio 2007) A consulta às massas atômicas dos elementos que compõem o sulfato de alumínio e hidróxido de sódio nos possibilita chegar às suas massas molares (M): M(AL2(SO4)3) = 342 g mol-1 e M(NaOH) = 40,0 g mol-1.
Sabendo-se que 6,02 × 1023 é o número de espécies em um mol de qualquer substância, é correto afirmar que a relação entre massas de um mesmo número de espécies de sulfato de alumínio e hidróxido de sódio é igual a:
a) 1,71.
b) 3,42.
c) 5,13.
d) 6,84.
e) 8,55.
Questão 02. (UERJ/2008) Em grandes depósitos de lixo, vários gases são queimados continuamente. A molécula do principal gás que sofre essa queima é formada por um átomo de carbono e átomos de hidrogênio. O peso molecular desse gás, em unidades de massa atômica, é igual a:
a) 10.
b) 12.
c) 14.
d) 16.
Questão 03. (UFLA/2008) Segundo orientações nutricionais, a dose diária recomendada de vitamina C (C6H8O6) a ser ingerida por uma pessoa adulta é 62 mg. Um determinado cientista, grande defensor das propriedades terapêuticas dessa vitamina, consumia diariamente 7,05 × 103 mol da mesma. A dose ingerida pelo cientista é quantas vezes maior que a recomendada?
a) 200,0.
b) 1,2.
c) 2,0.
d) 20,0.
Questão 04 sobre Teoria Atômico Molecular: (Pucamp/05) Considere a figura a seguir que representa tipos de raízes encontrados em plantas dos manguezais.
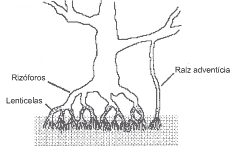
No mangue, uma das formas de produção de H2S é através de bactérias que reduzem íons sulfato a íons sulfeto. Sendo assim, o quociente entre as massas, em g, de íons sulfato (SO4–2) consumido e íons sulfeto (S–2) produzido é igual a:
Dados: massa molares (g ⋅ mol-1)
hidrogênio (H) = 1,0
oxigênio (O) = 16
Enxofre (S) = 32
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
Questão 05. (Pucamp/05) Na batalha contra o ‘Mycobacterium tuberculosis’, a principal bactéria causadora da tuberculose, um grupo de pesquisadores brasileiros espera, em breve, fornecer um novo arsenal de armas químicas: drogas sintéticas desenhadas para explorar os pontos fracos do patógeno. O objetivo é matá-lo de forma mais rápida e menos tóxica ao homem.
Uma molécula com aparente potencial para atingir esse objetivo foi batizada, informalmente, de IQG 607, um ferrocianeto associado à molécula da isoniazida (INH), droga que há 50 anos é o carro-chefe no tratamento contra tuberculose. A isoniazida corresponde a um derivado do ácido nicotínico, denominada também de isonicotinilhidrazina.
Observe sua fórmula estrutural a seguir.
Adaptado de Pesquisa “FAPESP 97”. Março de 2004. p. 32.
Sabendo-se que
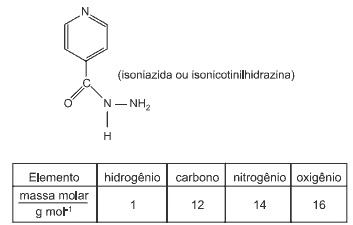
pode-se calcular a massa molar da isoniazida. Seu valor, em g . mol-1, é
a) 137.
b) 125.
c) 121.
d) 120.
e) 107.
Questão 06. (Fuvest/07) Alguns problemas de saúde, como bócio endêmico e retardo mental, são causados pela ingestão de quantidades insuficientes de iodo. Uma maneira simples de suprir o organismo desse elemento químico é consumir o sal de cozinha que contenha de 20 a 60 mg de iodo por quilograma do produto. No entanto, em algumas regiões do País, o problema persiste, pois o sal utilizado ou não foi produzido para consumo humano, ou não apresenta a quantidade mínima de iodo recomendada. A fonte de iodo utilizada na indústria do sal é o iodato de potássio, KIO3, cujo custo é de R$ 20,00/kg. Considerando que o iodo representa, aproximadamente, 60% da massa de KIO3 e que 1 kg do sal de cozinha é comercializado ao preço médio de R$ 1,00, a presença da quantidade máxima de iodo permitida por lei (60 miligramas de iodo por quilograma de sal) representa, no preço, a porcentagem de:
a) 0,10%.
b) 0,20%.
c) 1,20%.
d) 2,0%.
e) 12%.
Questão 07 sobre Teoria Atômico Molecular: (UFPE/2003) A relação entre a quantidade de átomos e uma determinada massa da substância é um dos marcos na História da Química, pois é um dos exemplos que envolvem grandes números. Considere os sistemas a seguir:
I. 100 átomos de chumbo
II. 100 g de chumbo
II. 100 mols de hélio
IV. 100 g de hélio
Considerando as seguintes massas atômicas (g/mol) He = 4 e Pb = 207, assinale a alternativa que representa a ordem crescente de número de átomos nos sistemas anteriores.
a) III < I < IV < II.
b) III < II < I < IV.
c) I < III < IV < II.
d) I < IV < III < II.
e) IV < III < II < I.
Questão 08. (UFSCar/04) A cafeína – um estimulante do sistema nervoso central cuja estrutura é representada na figura – é um alcaloide encontrado nos grãos de café, em folhas de alguns tipos de chá e em refrigerantes à base de cola. A tabela representa o conteúdo de cafeína em 200 mL de algumas bebidas:
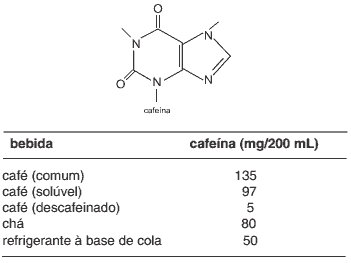
a) Determine o número de átomos de carbonos secundários presentes em uma molécula de cafeína. Para isso, transcreva a estrutura da cafeína e identifique, marcando com uma seta, todos os átomos de carbonos secundários.
b) Determine a quantidade de mols de moléculas de cafeína – fórmula molecular C8H10N4O2 – presentes em uma xícara de 200 mL de café solúvel.
Questão 09. (Uespi 2012) Os avanços tecnológicos na eletrônica levaram à invenção do espectrômetro de massa, um aparelho que determina a massa de um átomo. Um mineiro, procurando ouro em um riacho coleta, 10 g de peças finas de ouro conhecidas como “pó de ouro”. Sabendo que a massa de um átomo de ouro é 3,27 ⋅ 10-25 kg, calcule quantos átomos de ouro o mineiro coletou.
a) 3 1025
b) 3 1022
c) 5 1020
d) 5 1017
e) 7 1016
Questão 10 sobre Teoria Atômico Molecular: (Unesp/2003) As hemácias apresentam grande quantidade de hemoglobina, pigmento vermelho que transporta oxigênio dos pulmões para os tecidos. A hemoglobina é constituída por uma parte não proteica, conhecida como grupo heme. Num laboratório de análises, foi feita a separação de 22,0 mg de grupo heme de uma certa amostra de sangue, onde constatou-se a presença de 2,0 mg de ferro. Se a molécula do grupo heme contiver apenas um átomo de ferro [Fe = 56 g/mol], qual a sua massa molar em gramas por mol?
a) 154.
b) 205.
c) 308.
d) 616.
e) 1.232.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre a Teoria Atômico Molecular:
01. e;
02. d;
03. d;
04. c;
05. a;
06. b;
07. c;
08. a.
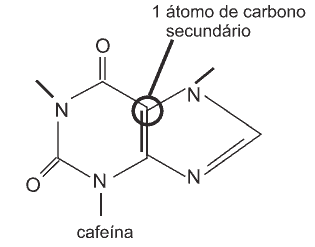
b) Em 200 mL de café, encontramos 97 mg (97 . 10-3 g) de cafeína, então:
1 mol (cafeína) ———————- 194 g
n (cafeína)—————–97 . 10-3 g
n(cafeína) = 5 . 10-4 mol
09. b
Teremos:
1 átomo de ouro –––––––– 3,27 x 10-25 x 103 g
n átomos de ouro ––––––– 10 g
n = 3,06 x 1022 átomos de ouro
10. c
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
