Questões 01 sobre Titulometria: (PUC-PR/2003) Uma solução de ácido sulfúrico é titulada com outra solução 0,20 molar de NaOH. Quantos mL da solução básica serão necessários para neutralizar completamente 0,098 g deste ácido?
(Dados: H = 1,00 g/mol; O = 16,00 g/mol; Na = 23,00 g/mol; S = 32,00 g/mol.)
a) 5,00 mL.
b) 2,50 mL.
c) 10,00 mL.
d) 15,00 mL.
e) 20,00 mL.
Questões 02. (UFPE/2003) A solubilidade do oxalato de cálcio a 20°C é de 33,0 g por 100 g de água. Qual a massa, em gramas, de CaC2O4 depositada no fundo do recipiente quando 100 g de CaC2O4 (s) são adicionados em 200 g de água a 20°C?
Questões 03 sobre Titulometria: (Cesgranrio/2002) A contaminação ambiental tem sido uma fonte de problemas e doenças em diversas comunidades. Um relatório aponta a contaminação de, pelo menos, 150 pessoas em Paulínia, São Paulo.
Dezoito delas apresentaram tumores no fígado e na tireoide. Todas teriam sido contaminadas por substâncias usadas na fabricação de pesticidas. Dr. Anthony Wong, pediatra e diretor do Centro de Assistência de Toxicologia, do Hospital das Clínicas da Universidade de São Paulo, afirma que a intenção não é criar pânico na população, mas é necessário ter muita cautela, porque há substâncias, como o benzeno, clorobenzeno e metil-etilcetona (butanona), perigosas para mulheres grávidas, crianças e idosos, que são os mais vulneráveis. Além disso, vapores tóxicos do clorobenzeno afetam o rim e o fígado. Fez, ainda, um outro alerta: as pessoas não sentem o cheiro porque a sua concentração na fase gasosa é pequena. Ambientalistas lutam para que o índice ideal de exposição ao benzeno seja 0,1 ppm.
A concentração de uma solução, em ppm, pode ser expressa na forma de miligramas de soluto em 1 litro de solução. Numa atmosfera, para se chegar ao nível de concentração ideal de exposição ao benzeno, desejado pelos ambientalistas, a quantidade máxima desse composto cancerígeno, em gramas, que pode estar presente em um ambiente de 10.000 L é igual a:
a) 0,10.
b) 0,81.
c) 1,0.
d) 1,67.
e) 10.
(Enem/2003) O texto abaixo refere-se às questões 4 e 5.
O botulismo, intoxicação alimentar que pode levar à morte, é causado por toxinas produzidas por certas bactérias, cuja reprodução ocorre nas seguintes condições: é inibida por pH inferior a 4,5 (meio ácido), temperaturas próximas a 100°C, concentrações de sal superiores a 10% e presença de nitritos e nitratos como aditivos.
Questões 04. (Enem) A ocorrência de casos recentes de botulismo em consumidores de palmito em conserva levou a Agência Nacional de Vigilância Sanitária (ANVISA) a implementar normas para a fabricação e comercialização do produto. No rótulo de uma determinada marca de palmito em conserva, encontram-se as seguintes informações:
I. Ingredientes: Palmito açaí, sal diluído a 12% em água, ácido cítrico;
II. Produto fabricado conforme as normas da ANVISA;
III. Ecologicamente correto.
As informações do rótulo que têm relação com as medidas contra o botulismo estão contidas em
a) II, apenas.
b) III, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I, II e III.
Questões 05 sobre Titulometria: Levando-se em conta os fatores que favorecem a reprodução das bactérias responsáveis pelo botulismo, conclui-se que as toxinas que o causam têm maior chance de serem encontradas:
a) em conservas com concentração de 2 g de sal em 100 g de água.
b) nas linguiças fabricadas com nitrito e nitrato de sódio.
c) nos alimentos logo após terem sido fervidos.
d) no suco de limão, cujo pH varia de 2,5 a 3,6.
e) no charque (carne salgada e seca ao sol).
Questões 06. (PUC-SP/07) Dado: coloração do indicador azul de bromotimol
pH < 6 → solução amarela
6 < pH < 8 → solução verde
pH > 8 → solução azul
Em um béquer foram colocados 20,0 mL de solução aquosa de hidróxido de sódio (NaOH) de concentração 0,10 mol/L e algumas gotas do indicador azul de bromotimol. Com auxílio de uma bureta foram adicionados 20,0 mL de uma solução aquosa de ácido sulfúrico (H2SO4) de concentração 0,10 mol/L.
A cada alíquota de 1,0 mL adicionada, a mistura resultante era homogeneizada e a condutibilidade da solução era verificada através de um sistema bastante simples e comum em laboratórios de ensino médio. Uma lâmpada presente no sistema acende quando em contato com um material condutor, como água do mar ou metais, e não acende em contato com materiais isolantes, como água destilada, madeira ou vidro.
A respeito do experimento, é correto afirmar que:
a) após a adição de 10,0 mL da solução de H2SO4, a solução apresenta coloração azul e a lâmpada acende.
b) após a adição de 10,0 mL da solução de H2SO4, a solução apresenta coloração verde e a lâmpada não acende.
c) após a adição de 12,0 mL da solução de H2SO4, a solução apresenta coloração azul e a lâmpada acende.
d) após a adição de 12,0 mL da solução de H2SO4, a solução apresenta coloração amarela e a lâmpada acende.
e) após a adição de 20,0 mL da solução de H2SO4, a solução apresenta coloração verde e a lâmpada não acende.
Questões 07 sobre Titulometria: (PUC-Rio/07) Considere a reação de 100 mL de uma solução aquosa 1,0 × 10-1 mol ⋅ L-1 de H2SO4 com 200 mL de solução aquosa 2,0 × 10-2 mol ⋅ L-1 de Ca(OH)2, segundo a equação:
H2SO4(aq) + Ca(OH)2(aq) → CaSO4(s) + 2 H2O(l)
Assinale a alternativa que indica, com maior aproximação, a quantidade máxima de CaSO4, que pode ser obtida nessa reação.
a) 0,002 mol.
b) 0,004 mol.
c) 0,006 mol.
d) 0,01 mol.
e) 0,08 mol.
Questões 08. (UFC/07) Em um balão volumétrico, foram colocados 6 g de hidróxido de sódio impuro e água destilada até completar um volume de 250 mL. Para a neutralização completa de 50 mL desta solução, foram necessários 60 mL de H2SO4 0,1 mol ⋅ L-1.
Sabendo que as impurezas existentes são inertes na presença de H2SO4, o percentual de pureza do hidróxido de sódio utilizado é igual a:
a) 10.
b) 20.
c) 40.
d) 60.
e) 80.
Questões 09 sobre Titulometria: (Unicamp/07) O boro é um micronutriente para plantas com importante papel no processo de germinação e na formação de frutos, de grãos e de sementes. A solubilidade dos sais de boro em água constitui um problema para a correção da deficiência desse elemento, que é facilmente “arrastado” pela chuva. Esse problema pode ser contornado pelo uso de materiais que adsorvam os sais de boro, liberando-os lentamente para a umidade do solo. O gráfico a seguir mostra a quantidade de boro adsorvido (Y/m) por alguns materiais em função da concentração do boro em solução aquosa.
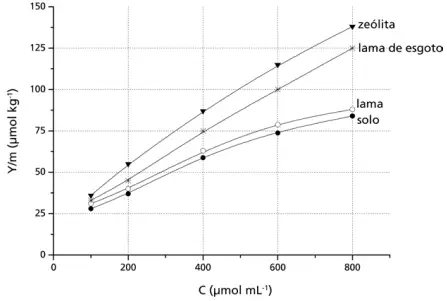
De acordo com o gráfico:
a) Dos materiais em questão, qual é o mais eficiente para a retenção do boro? Justifique sua resposta.
b) Para uma concentração de boro de 600 mmol mL1, quanto o material do item “a” adsorve a mais que o solo em mmol de boro por tonelada?
c) Entre as concentrações de 300 e 600 mmol mL1, as adsorções podem ser descritas, aproximadamente, por retas. Levando isso em conta, escreva, para o caso da lama de esgoto, a equação da reta que correlaciona Y/m com C.
Questões 10 sobre Titulometria: (Uerj/2010) Em processos de gravação de letras e figuras em peças de vidro, o ácido fluorídrico reage com o dióxido de silício, principal constituinte do vidro, de acordo com a seguinte equação:
SiO2(s) + 4 HF(aq) → SiF4(g) + 2 H2O(l)
Na gravação de letras em uma determinada peça de vidro, foi empregada uma solução aquosa de HF com concentração de 2,0 mol ⋅ L-1, verificando-se a formação de 1,12 L de SiF4, medidos nas CNTP. O volume, em mililitros, de solução ácida utilizado correspondeu a:
a) 50
b) 100
c) 150
d) 200
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das atividades de química sobre Titulometria:
01. c;
02. 34;
03. c;
04. c;
05. a;
06. d;
07. b
08. c;
09. a. A zeólita é o material que apresenta maior efciência para a retenção de boro, pois é o que apresenta maior valor de adsorção Y/m para qualquer concentração de boro.
b. Adsorve 37,5 . 103 mmol por tonelada.
c. A equação da reta é Y/m = 0,125 C + 25.
10. b
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
