Questão 01 sobre Soluto, Solução e Concentração Química: (UFJF-MG) A cada dia, mais pessoas são vítimas de acidentes de trânsito em função do uso de bebidas alcoólicas. Quando uma pessoa ingere bebidas alcoólicas, o álcool passa rapidamente para a corrente sanguínea e é levado para todas as partes do corpo. Como resultado, a capacidade da pessoa para conduzir veículos é altamente comprometida, tendo em vista que a intoxicação afeta a coordenação motora e a rapidez dos reflexos. De acordo com a legislação brasileira em vigor, uma pessoa está incapacitada para dirigir com segurança se tiver uma concentração de álcool no sangue superior a 0,8 g.L31.
QUÍMICA NOVA NA ESCOLA, 1997.
Pergunta-se: quantos copos de cerveja de 300 mL uma pessoa de porte médio, que tem um volume sanguíneo de aproximadamente 5 litros, pode tomar para ainda estar capacitada a dirigir?
Observação: O cálculo efetuado considera que todo o álcool ingerido passa para o sangue. Na realidade, pode-se ingerir um pouco mais que o calculado e ainda estar dentro do limite legal, tendo em vista que vários mecanismos no organismo se encarregam de eliminar a substância tóxica.
Dado: Teor alcoólico da cerveja = 32 g.L-1.
A) 1
B) 2
C) 3
D) 4
E) Nenhum
Questão 02. (UFOP-MG–2009) Durante uma festa, um convidado ingeriu 5 copos de cerveja e 3 doses de uísque. A cerveja contém 5% V/V de etanol e cada copo tem um volume de 0,3 L; o uísque contém 40% V/V de etanol e cada dose corresponde a 30 mL. O volume total de etanol ingerido pelo convidado durante a festa foi de:
A) 111 mL.
B) 1,11 L.
C) 15,9 mL.
D) 1,59 L.
Questão 03 sobre Soluto, Solução e Concentração Química: (UFJF-MG–2006) O ozônio (O3) é nosso aliado na estratosfera, protegendo contra a incidência de raios ultravioleta. No entanto, torna-se um inimigo perigoso no ar que respiramos, próximo à superfície da Terra. Concentrações iguais ou superiores a 0,12 L de O3 em um milhão de litros de ar podem provocar irritação nos olhos e problemas pulmonares, como edema e hemorragia.
Esta concentração limite de ozônio corresponde a:
A) 0,12 ppm.
B) 1,2 ppm.
C) 0,012 ppm.
D) 12 ppm.
E) 120 ppm.
Questão 04. (UFLA-MG–2009) Preparou-se uma solução de (NH4)3PO4 de concentração 0,10 mol.L-1. Do frasco que continha a solução, foram retirados 25 mL. É INCORRETO afirmar que, nesses 25 mL, pode-se encontrar:
A) 0,0025 mol de PO43-.
B) 0,10 mol de (NH4)3PO4.
C) 0,03 mol de H.
D) 0,01 mol de O.
Questão 05 sobre Soluto, Solução e Concentração Química: (UFV-MG) Soluções fisiológicas aquosas de NaCl a 0,9% (m/V) são usadas na limpeza de lentes de contato, nebulização, limpeza de escoriações, etc. As concentrações aproximadas dessas soluções, expressas em mol/L e mg/L, são, respectivamente:
A) 1,5×10-2 e 9,0×102.
B) 1,5×10-2 e 9,0×103.
C) 1,5×10-1 e 9,0×104.
D) 1,5×10-1 e 9,0×103.
E) 1,5×10-1 e 9,0×102.
Questão 06. (PUC Minas) Uma solução aquosa de cloreto de cálcio, soluto totalmente dissociado, foi preparada pela dissolução de 33,3 g desse sal, em água suficiente para 500 mL de solução. A concentração de íons cloreto, em mol de Cl–/L de solução, é igual a:
A) 0,3.
B) 0,6.
C) 0,9.
D) 1,2.
Questão 07 sobre Soluto, Solução e Concentração Química: (FMTM-MG) Os açúcares mais complexos normalmente são convertidos em glicose (C6H12O6), uma das principais fontes de energia para o ser humano. A alimentação intravenosa hospitalar consiste, usualmente, em uma solução de glicose em água com adição de sais minerais. No preparo de um medicamento, foram utilizados 2,5 g de glicose dissolvidos em 90 mL de água. A concentração em quantidade de matéria desse medicamento é:
Dado: Massa molar da glicose = 180 g.mol–1
A) 9,6×10-5 .
B) 5,0×10-4 .
C) 2,5×10-3 .
D) 1,54×10-1 .
E) 3,6×10-1 .
Questão 08. (VUNESP–2006) Uma pastilha contendo 500 mg de ácido ascórbico (vitamina C) foi dissolvida em um copo contendo 200 mL de água. Dadas as massas molares C = 12 g.mol-1, H = 1 g.mol-1 e O = 16 g.mol-1 e a fórmula molecular da vitamina C, C6H8O6, a concentração da solução obtida é:
A) 0,0042 mol.L-1.
B) 0,0142 mol.L-1.
C) 2,5 mol.L-1.
D) 0,5 g.L-1.
E) 5,0 g.L-1.
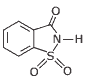
Questão 09. (UFV-MG–2006) A sacarina (estrutura a seguir) em soluções aquosas diluídas é cerca de 500 vezes mais doce que a sacarose (açúcar comum). A concentração mínima de sacarina em uma solução para que o sabor doce seja detectável é de aproximadamente 5,5×10–2 mol.L–1. Considerando-se essas informações, é CORRETO afirmar que a quantidade mínima necessária de sacarina para preparar 100 mL de solução, que apresente sabor doce, é:
A) 0,001 g.
B) 0,01 g.
C) 0,1 g.
D) 1 g.
E) 10 g.
Questão 10 sobre Soluto, Solução e Concentração Química: (UFJF-MG–2010) A concentração em mol/L de uma solução de ácido sulfúrico de concentração 35% em massa e densidade 1,4 g/mL é, aproximadamente, igual a:
A) 2,5.
B) 10,0.
C) 5,0.
D) 7,5.
E) 20.
🔵 >>> Confira a lista completa com todos os exercícios de Química..
Gabarito com as respostas dos exercícios sobre Soluto, Solução e Concentração Química:
01. E;
02. A;
03. A;
04. B;
05. D;
06. D;
07. D;
08. B;
09. D;
10. C;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
