Questão 01 sobre Ligações Intermoleculares: (ITA) Considerando a família do oxigênio, nota-se que os hidretos do tipo H2X, dos elementos dessa família, são todos gasosos nas CNTP, menos o de oxigênio. Essa situação é consequência:
a) do baixo peso molecular da H2O.
b) das ligações covalentes.
c) das pontes de hidrogênio entre as moléculas.
d) do fato de o oxigênio ser o átomo dessa família que tem o maior raio atômico.
e) do fato de que nas CNTP o gelo é menos denso que a água líquida.
Questão 02. (Cescem) No nitrogênio solidificado, as moléculas adjacentes, N2, serão unidas por ligações:
a) de Van der Waals.
b) de dipolos.
c) covalentes.
d) iônicas.
e) hibridizadas.
Questão 03. (FCC) À temperatura ambiente acetona evapora mais rapidamente do que a água. Sendo assim, pode-se concluir que, em relação à água, a acetona apresenta:
a) ponto de ebulição mais alto.
b) ligações intermoleculares mais fracas.
c) pressão de vapor menor.
d) pontes de hidrogênio em maior número.
e) configuração geométrica menos simétrica.
Questão 04 sobre Ligações Intermoleculares: (UFSE) Na seguinte estrutura:
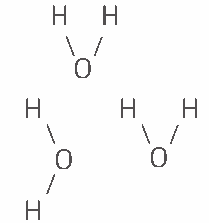
Estão representadas moléculas de água unidas entre si por ligações:
a) covalentes.
b) iônicas.
c) por pontes de hidrogênio.
d) por pontes de oxigênio.
e) peptídicas.
Questão 05. (Fuvest) A tensão superficial, que provém das forças de atração intermoleculares, é maior na água ou no éter etílico? Por quê?
[Dado: éter etílico: H3C – CH2 – O – CH2 – CH3 ].
Questão 06. (PUC) A congelação da água nas superfícies dos lagos em países frios ocorre pela:
a) ruptura de ligações intermoleculares.
b) ruptura de ligações intramoleculares.
c) formação de ligações intermoleculares.
d) formação de ligações intramoleculares.
e) formação de ligações intramoleculares e intermoleculares.
Questão 07 sobre Ligações Intermoleculares: (UFJF) Escreva o tipo de ligação intermolecular existente em cada substância citada.
a) Cloreto de hidrogênio líquido.
b) Água líquida.
c) Gás nobre hélio na fase líquida.
d) Iodo na fase sólida.
Questão 08. (UFU) Um químico compilou os valores dos pontos de ebulição dos haletos de hidrogênio. Os resultados foram os seguintes:

a) Por que essas substâncias apresentam diferentes pontos de ebulição?
b) Explique por que o HF tem ponto de ebulição superior aos demais.
c) Explique a ordem dos pontos de ebulição dos três últimos compostos.
Questão 09. (UFRGS) Analise os dados da tabela seguinte em relação às forças de interação entre as unidades constituintes dos sólidos.
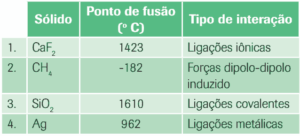
A ordem crescente das forças de interação, nesses sólidos, é:
a) 1, 3, 2, 4.
b) 2, 3, 1, 4.
c) 2, 4; 1; 3.
d) 3, 1, 4, 2.
e) 4, 2, 3, 1.
Questão 10 sobre Ligações Intermoleculares: Uma molécula do tipo ![]() tem geometria?
tem geometria?
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre Ligações Intermoleculares:
1. C;
2. A;
3. B;
4. C;
5. Na água, por apresentar pontes de hidrogênio.
6. C;
7.
a) Forças dipolo-dipolo.
b) Pontes de hidrogênio.
c) Forças de Van der Waals.
d) Forças de Van der Waals.
8.
a) Os PE dependem das massas das moléculas e das forças de atração intermoleculares.
b) Entre as moléculas de HF existem pontes de hidrogênio.
c) Os PE estão crescendo na ordem crescente das massas das moléculas.
9. C;
10. A;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
