Questão 01 com Atividades sobre Ligações Químicas: (UERJ) As fotocélulas são dispositivos largamente empregados para acender lâmpadas, abrir portas, tocar campainhas etc. O seu mecanismo baseia-se no chamado “efeito fotoelétrico”, que é facilitado quando se usam metais com energia de ionização baixa. Os metais que podem ser empregados para esse fim são: sódio, potássio, rubídio e césio.
Escreva a fórmula mínima do composto formado pelo ânion O2- e o cátion potássio.
Questão 02. (Vunesp) Tem-se dois elementos químicos A e B, com números atômicos iguais a 20 e 35, respectivamente.
a) Escrever as configurações eletrônicas dos dois elementos. Com base nas configurações, dizer a que grupo de tabela periódica pertence cada um dos elementos em questão.
b) Qual será a fórmula do composto formado entre os elementos A e B? Que tipo de ligação existirá entre A e B no composto formado? Justificar.
Questão 03. (UFRJ) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características.
Recorra à tabela periódica e determine:
a) O elemento que tem distribuição eletrônica s2 p4 no nível mais energético, é o mais eletronegativo de seu grupo e forma, com os metais alcalinosterrosos, composto do tipo XY.
b) O número atômico do elemento que perde dois elétrons ao formar ligação iônica e está localizado no 3.º período da tabela periódica.
Questão 04. (UFRJ) Os elementos do 4.º período da tabela periódica são aqueles que apresentam elétrons distribuídos pelos quatro primeiros níveis de energia.
a) Apresente a fórmula do composto iônico formado pelos elementos de maior e de menor eletronegatividade desse período.
b) Os três metais do grupo 8B desse período apresentam propriedades magnéticas. Tal fato está relacionado à presença de elétrons desemparelhados em suas distribuições eletrônicas.
Selecione o metal de menor massa atômica dentre esses três e faça sua distribuição eletrônica.
Questão 05 com Atividades sobre Ligações Químicas: (UERJ) A figura abaixo representa o átomo de um elemento químico, de acordo com o modelo de Bohr.
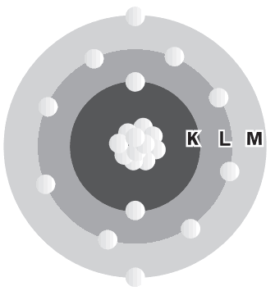
(HARTWIG, D. R. et al. Química Geral e Inorgânica. São Paulo: Scipione, 1999.)
Para adquirir estabilidade, um átomo do elemento representado pela figura deverá efetuar ligação química com um único átomo de outro elemento, cujo símbolo é:
a) C.
b) F.
c) P.
d) S.
Questão 06. (UERJ) Sou o átomo (Y) de maior raio atômico do 3.º período da classificação periódica e formo com os halogênios (X) sais do tipo YX. Eu sou representado pelo seguinte símbolo:
a) Al.
b) Cl.
c) Mg.
d) Na.
Questão 07. (PUC) Os elementos X (Z=16) e Y (Z=20), ao se combinarem, formam um composto. São propriedades características desse composto:
a) se fundido, não conduz corrente elétrica.
b) sólido e, nesse estado, condutor de corrente elétrica.
c) líquido, polar.
d) apolar, não condutor de corrente elétrica.
e) sólido, de ponto de fusão elevado.
Questão 08. (UEL) A posição dos elementos químicos na tabela periódica permite prever que resulta num composto iônico a combinação entre:
a) cálcio e flúor.
b) hidrogênio e oxigênio.
c) fósforo e iodo.
d) nitrogênio e cloro.
e) carbono e hidrogênio.
Questão 09. (UERJ) O experimento clássico de Rutherford levou à descoberta do núcleo atômico e abriu um novo capítulo no estudo da Estrutura da Matéria, ao fazer incidir um feixe de partículas sobre um alvo fixo no laboratório. As partículas desviadas eram observadas com detectores de material cintilante. Experimentos desse tipo são ainda realizados hoje em dia. Nesse experimento, o sulfeto de zinco era o material que cintilava quando recebia o choque das partículas alfa. Outra substância que apresenta excelentes características para detecção de tais partículas, utilizando ainda material cintilante, possui ligação interatômica de caráter predominantemente iônico e é formada por um metal representativo e um ametal.
A fórmula dessa outra substância é:
a) BaF2.
b) BeI2.
c) SiO2.
d) FeCl2.
Questão 10 com Atividades sobre Ligações Químicas: (Unificado) O bário é um metal utilizado em velas para motores, pigmento para papel e fogos de artifício. A respeito de algumas características do bário, assinale a opção incorreta.
a) Tem altos pontos de fusão e ebulição.
b) Conduz bem a corrente elétrica no estado sólido.
c) Forma composto iônico quando se liga ao flúor.
d) Pertence a família dos metais alcalino-terrosos.
e) Tende a receber dois elétrons quando se liga ao oxigênio
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de Atividades sobre Ligações Químicas:
01. K2O.
02.
a) A: 1s 2 2s2 2p6 3s2 3p6 4s2 grupo II A.
B: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 grupo VII A.
b) AB2 ligação iônica, onde A = metal e B = ametal.
03.
a) Oxigênio.
b) Z = 12.
04.
a) KBr.
b)
26Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
05. D;
06. D;
07. E;
08. A;
09. A;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
