Questão 01 sobre Eletroquímica: UFPI – Pilhas são dispositivos nos quais energia química é convertida em energia elétrica, através de reações de oxi-redução. Sendo dada a série eletroquímica em ordem crescente de reatividade como se segue: ouro, prata, cobre, hidrogênio, níquel, ferro, zinco e manganês, analise as afirmativas abaixo.
I. espécies químicas situadas antes do hidrogênio têm caráter anódico em relação as que os seguem;
II. a maior diferença de potencial (ddp) na série dos elementos zinco e manganês;
III. a energia química da pilha Zn-Ni é maior do que da pilha Zn-Fe.
Dentre as afirmativas acima marque a opção correta:
a) apenas I é verdadeira;
b) apenas II é verdadeira;
c) I e II são verdadeiras;
d) II e III são verdadeiras;
e) apenas III.
Questão 02. UFPI – Os fabricantes e importadores estão obrigados, por lei, a recolher as baterias usadas em telefones celulares por conterem metais pesados como o mercúrio, o chumbo e o cádmio. Assinale a afirmativa correta.
a) esses três metais são classificados como elementos de transição;
b) esses metais são sólidos à temperatura ambiente;
c) os elementos de massa molar elevada são denominados de metais pesados;
d) a pilha que não contém metais pesados pode ser descartada no lixo doméstico;
e) a contaminação da água por metais pesados ocorre devido a sua grande solubilidade neste solvente.
Questão 03 sobre Eletroquímica: Unifacs – As reações com substâncias capazes de gerar corrente elétrica têm permitido ao homem construir pilhas cuja utilização é bastante ampla no mundo moderno.
Com base nos conhecimentos sobre eletroquímica, pode-se afirmar sobre o funcionamento das pilhas:
( ) A diferença de potencial independe da concentração das soluções empregadas.
( ) Com o uso, a diferença de potencial se reduz.
( ) Os elétrons fluem em direção ao cátodo.
( ) No ânodo, ocorre redução.
( ) No eletrodo, onde ocorre oxidação, há aumento de massa.
Questão 04. FUVEST-SP – O alumínio é produzido a partir do minério bauxita, do qual é separado o óxido de alumínio que, em seguida, junto a um fundente, é submetido à eletrólise. A bauxita contém cerca de 50%, em massa, de óxido de alumínio. De modo geral, desde que o custo da energia elétrica seja o mesmo, as indústrias de alumínio procuram se estabelecer próximas a:
a) zonas litorâneas, pela necessidade de grandes quantidades de salmoura para a eletrólise.
b) centros consumidores de alumínio, para evitar o transporte de material muito dúctil e maleável e, portanto, facilmente deformável.
c) grandes reservatórios de água, necessária para separar o óxido de alumínio da bauxita.
d) zonas rurais, onde a chuva ácida, que corrói o alumínio, é menos freqüente.
e) jazidas de bauxita, para não se ter de transportar a parte do minério (mais de 50%) que não resulta em alumínio.
Questão 05 sobre Eletroquímica: UFPE – As pilhas de níquel-cádmio, que viabilizaram o uso de telefones celulares e computadores portáteis, são baseadas na seguinte reação:
Cd(s) + NiO2(s) + H2O(l) → Cd(OH)2(s)+Ni(OH)2(s).
Considerando este processo, quantos mols de elétrons são produzidos por mol de cádmio consumido?
a) 0,5
b) 1
c) 2
d) 3
e) 4
Questão 06. UFPI – Uma das grandes preocupações das entidades esportivas diz respeito ao estado de deterioração dos estádios, provocado pelo fenômeno espontâneo da corrosão. Sabendo-se que entre os fatores que favorecem a velocidade de desgaste dos materiais, como o concreto e os ferros de suas armaduras, podem ser citadas a temperatura, a umidade relativa do ar, o grau de insolação e o teor de cloreto. Analise as afirmativas abaixo e marque a opção correta.
a) num processo espontâneo, a variação de entropia é menor do que zero;
b) quanto maior a temperatura, maior a corrosão, por ser maior a energia de ativação;
c) uma alta umidade relativa do ar favorece a formação de eletrolito de uma célula eletroquímica;
d) a célula eletroquímica espontânea da corrosão da armadura do concreto é de natureza eletrolítica;
e) quanto maior a concentração de cloreto, maior é a velocidade de redução do ferro.
Questão 07 sobre Eletroquímica: UEMS – A massa de sódio depositada, quando uma corrente de 15A atravessa uma certa quantidade de NaCl fundido durante 20,0 minutos, é:
Dados carga de 1 mol de elétrons = 96500C
a) 42,9 g
b) 6,62 g
c) 4,29 g
d) 66,2 g
e) 10,9 g
Questão 08. UFR-RJ – A prateação pelo processo galvânico é de grande utilidade, tendo em vista que com um gasto relativamente pequeno consegue-se dar uma perfeita aparência de prata aos objetos tratados.
A massa de prata (em gramas), depositada durante a prateação de uma pulseira de bijuteria, na qual foi envolvida uma carga equivalente a 4.825C, corresponde aproximadamente a:
a) 54 g
b) 27 g
c) 10,8 g
d) 5,4 g
e) 1,08 g
Questão 09. UFRN – Na molécula de propeno, qualquer um dos carbonos com hibridização sp2 apresenta:
a) 1 ligação sigma e 3 ligações pi.
b) 4 ligações sigma e 2 pi.
c) 2 ligações sigma e 2 pi.
d) 3 ligações sigma e 1 ligação pi.
Questão 10 sobre Eletroquímica: UFRS – Um estudante apresentou um experimento sobre eletrólise na feira de ciências de sua escola. O esquema do experimento foi representado pelo estudante em um cartaz como o reproduzido abaixo:
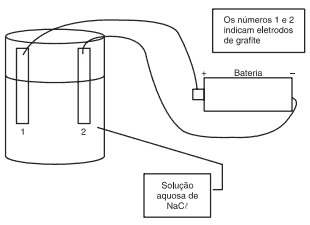
Em outro cartaz, o aluno listou três observações que realizou e que estão transcritas abaixo:
I. Houve liberação de gás cloro no eletrodo 1.
II. Formou-se uma coloração rosada na solução próxima ao eletrodo 2, quando se adicionaram gotas de solução de fenolftaleína.
III. Ocorreu uma reação de redução do cloro no eletrodo 1.
Quais observações são corretas?
a) Apenas I.
b) Apenas II.
c) Apenas III.
d) Apenas I e II.
e) I, II e III.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com exercícios sobre Eletroquímica para passar no Enem:
01. e;
02. e;
03. c;
04. e;
05. d;
06. c;
07. c;
08. d;
09. b;
10. d
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
