Questão 01 sobre Eletrólise: (Fuvest) Industrialmente, alumínio é obtido a partir da bauxita. Esta é primeiro purificada, obtendo-se o óxido de alumínio, Al2O3, que é, em seguida, misturado com um fundente e submetido a uma eletrólise ígnea, obtendo-se, então, o alumínio. As principais impurezas da bauxita são: Fe2O3, que é um óxido básico e SiO2, que é um óxido ácido.
Quanto ao Al2O3, trata-se de um óxido anfótero, isto é, de um óxido que reage tanto com ácidos quanto com bases.
a) Na primeira etapa de purificação da bauxita, ela é tratada com solução aquosa concentrada de hidróxido de sódio. Neste tratamento, uma parte apreciável do óxido de alumínio solubiliza-se, formando NaAl(OH)4. Escreva a equação química balanceada que representa tal transformação.
b) Se a bauxita fosse tratada com solução aquosa concentrada de ácido clorídrico, quais óxidos seriam solubilizados? Justifique por meio de equações químicas balanceadas.
c) Na eletrólise do óxido de alumínio fundido, usam-se várias cubas eletrolíticas ligadas em série, através das quais passa uma corrente elétrica elevada.
Se n cubas são ligadas em série e a corrente é I, qual deveria ser a corrente, caso fosse usada apenas uma cuba, para produzir a mesma quantidade de alumínio por dia? Justifique, com base nas leis da eletrólise.
Questão 02. (PUCPR) É correto afirmar sobre o processo conhecido como banho de ouro:
I. Imersão em solução de ouro derretido.
II. Pintura metálica.
III. Deposição catalítica.
IV. Eletrodeposição.
V. Reação com ouro em altas temperaturas.
Está correta ou estão corretas:
a) II e IV.
b) II, III e IV.
c) apenas II.
d) apenas IV.
e) II e III.
Questão 03 sobre Eletrólise: (UFCE) As estátuas de metal, em geral confeccionadas em cobre metálico, apresentam coloração típica. Com o passar do tempo, todavia, observa-se o aparecimento de uma coloração verde que é atribuída ao produto da reação de oxidação do cobre pelo ar. Considerando que tintas protetoras contendo metal podem funcionar como ânodo de sacrifício e conhecendo-se o valor do potencial padrão de redução da reação Cu2+ + 2e → Cu; E0 = + 0,34 V, analise a tabela a seguir.
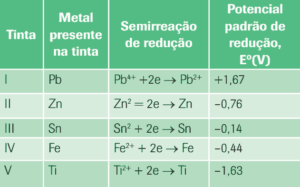
Considerando somente as informações contidas na questão, assinale a alternativa que apresenta a tinta mais eficaz na proteção de uma estátua de cobre.
a) Tinta I.
b) Tinta II.
c) Tinta III.
d) Tinta IV.
e) Tinta V.
Questão 04. (UFPE) A eletrólise de cloreto de sódio fundido produz sódio metálico e gás cloro. Nesse processo, cada íon:
a) sódio recebe dois elétrons.
b) cloreto recebe um elétron.
c) sódio recebe um elétron.
d) cloreto perde dois elétrons.
e) sódio perde um elétron.
Questão 05. (UFRRJ) Por uma solução aquosa de H2SO4, contida em uma cuba eletrolítica, faz-se passar durante 965 segundos uma corrente de 10A. Nas CNTP, os volumes de O2 e de H2 produzidos no ânodo e cátodo, respectivamente, são:
a) 1,12 e 0,56 litros.
b) 0,56 e 0,56 litros.
c) 5,6 e 11,2 litros.
d) 0,56 e 1,12 litros.
e) 1,12 e 1,12 litros.
Questão 06 sobre Eletrólise: (UFRRJ) Quais são os cátions que não tem prioridade em soluções aquosas?
Questão 07. (Elite) E quais ânions não tem prioridade?
Questão 08. (Elite) Explique por que a reação inversa da eletrólise é espontânea.
Questão 09. (UEL) Pretende-se cobrear, niquelar e cromar peças metálicas, depositando-se o metal por eletrólise de soluções aquosas apropriadas de sais contendo, respectivamente, Cu2+(aq), Ni2+(aq) e Cr3+(aq). Admitindo-se que esses sais sejam disponíveis e que o custo do processo de eletrólise seja apenas dependente do preço da eletricidade, a obtenção de 1kg de cada um desses metais deve ser cada vez mais cara na seguinte ordem:
a) Cu, Cr e Ni.
b) Cr, Ni e Cu.
c) Cu, Ni e Cr.
d) Cr, Cu e Ni.
e) Ni, Cr e Cu.
Questão 10 sobre Eletrólise: (UFAL) Um cubo de 1cm de aresta foi utilizado como eletrodo em uma eletrólise de solução aquosa contendo íons Ag+, sob corrente elétrica de 1A para que nele se deposite uma película de prata de 5 . 10-4 de espessura. O tempo de eletrólise deverá ser de, aproximadamente,
Dados:
Densidade da prata = 10,5g/cm3
Massa molar da prata = 108 g/mol
1 faraday = 1 . 105C/mol
a) 10s
b) 20s
c) 30s
d) 40s
e) 50s
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de atividades de Eletroquímica sobre Eletrólise:
01.

02. D;
03. E;
04. C;
05. D
06. Os metais alcalinos, alcalinos terrosos e alumínio (Al++) perdem para o íon H+.
07. Ânions oxigenados e o íon F– perdem para o íon OH–.
08. A eletrólise não é uma reação espontânea, logo, a reação inversa será espontânea. Por isso, os produtos da eletrólise precisam ser separados; caso contrário, eles reagem ao entrarem em contato.
09. C;
10. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
