Questão 01 sobre Teoria das Colisões e Complexo Ativado: (UFRGS) As figuras a seguir representam as colisões entre as moléculas reagentes de uma mesma reação em três situações.
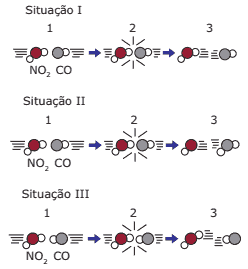
Pode-se afirmar que:
A) na situação I, as moléculas reagentes apresentam energia maior que a energia de ativação, mas a geometria da colisão não favorece a formação dos produtos.
B) na situação II, ocorreu uma colisão com geometria favorável e energia suficiente para formar os produtos.
C) na situação III, as moléculas reagentes foram completamente transformadas em produtos.
D) nas situações I e III, ocorreram reações químicas, pois as colisões foram eficazes.
E) nas situações I, II e III, ocorreu a formação do complexo ativado, produzindo novas substâncias.
Questão 02. (UFU-MG) Na natureza, algumas reações químicas ocorrem lentamente. A degradação de celulose vegetal, por exemplo, que origina carvão, demora milhões de anos, outras, como a oxidação de um pedaço de ferro exposto ao ar, demoram apenas alguns dias.
Indique a alternativa FALSA.
A) Em geral, o aumento da temperatura faz com que as moléculas sejam mais rápidas, tendo colisões mais energéticas e em maior número, aumentando a rapidez da reação.
B) Colisões efetivas são aquelas em que as moléculas possuem energia suficiente e orientação favorável para a quebra e a consequente formação de ligações.
C) Quando algum dos reagentes é sólido, sua trituração aumenta a rapidez da reação, porque a superfície de contato aumenta.
D) Catalisadores são reagentes que aceleram uma reação, alterando seu mecanismo através do aumento da energia de ativação, regenerando-se ao final do processo.
E) Quanto maior o número de colisões efetivas, maior é a rapidez da reação.
Questão 03 sobre Teoria das Colisões e Complexo Ativado: (UFMG) Considere a reação apresentada pela equação C(s) + O2(g) → CO2(g) ∆H = –393,5 kJ.mol–1. Todas as alternativas apresentam fatores que aumentam a rapidez da reação direta, EXCETO:
A) Aumento da concentração do oxigênio.
B) Diluição do sistema.
C) Elevação da temperatura.
D) Presença de um catalisador.
E) Pulverização do carbono.
Questão 04. (UEPG-PR–2007) A respeito dos fatores que influenciam a cinética de reações químicas, considere o que for CORRETO.
01. A energia de ativação de uma reação é independente da ação de um catalisador.
02. A velocidade da reação aumenta com o aumento da superfície de contato entre os reagentes.
04. A velocidade da reação aumenta com o aumento da temperatura, devido à maior frequência de colisões efetivas entre as moléculas dos reagentes.
08. Toda colisão com orientação adequada produz uma reação química.
Soma ( )
Questão 05 sobre Teoria das Colisões e Complexo Ativado: (UERJ) O gráfico a seguir refere-se às curvas de distribuição de energia cinética entre um mesmo número de partículas, para quatro valores diferentes de temperatura T1, T2, T3 e T4, sendo T1 < T2 < T3 < T4. Note que as áreas sob cada uma das curvas são idênticas, uma vez que são proporcionais a um mesmo número de partículas.
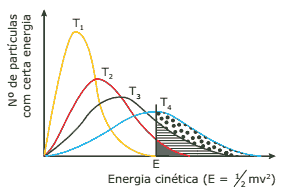
GEPEQ. Interações e transformações II. São Paulo: EDUSP, 1998 (Adaptação).
As transformações químicas serão tanto mais rápidas quanto maior for o número de colisões possíveis. Porém, isso depende não só do valor do número de colisões, mas também do valor mínimo da energia, chamado energia de limiar ou de ativação (por exemplo, a energia E indicada no gráfico).
Assim, com relação ao gráfico apresentado, a transformação química torna-se MAIS rápida na seguinte temperatura:
A) T1
B) T2
C) T3
D) T4
Questão 06. (UFMG) Em dois experimentos, massas iguais de ferro reagiram com volumes iguais da mesma solução aquosa de ácido clorídrico, à mesma temperatura. Em um dos experimentos, usou-se uma placa de ferro; no outro, a mesma massa de ferro, na forma de limalha. Nos dois casos, o volume total de gás hidrogênio produzido foi medido, periodicamente, até que toda a massa de ferro fosse consumida.
Assinale a alternativa cujo gráfico MELHOR representa as curvas do volume total do gás hidrogênio produzido em função do tempo.
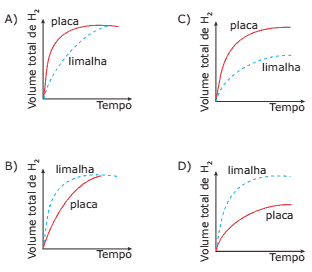
Questão 07 sobre Teoria das Colisões e Complexo Ativado: (Fatec-SP) A respeito da velocidade das reações químicas, podemos afirmar que:
A) o catalisador aumenta a velocidade da reação porque provoca um aumento na energia de ativação.
B) um aumento de 10 ºC na temperatura da reação, geralmente, diminui a velocidade à metade.
C) a reação de decomposição da água oxigenada é acelerada pela presença da luz.
D) a reação entre zinco e ácido clorídrico será mais rápida, trabalhando-se com zinco em pedra, do que com zinco em pó.
E) a velocidade da reação é independente da concentração molar dos reagentes.
Questão 08. (UFMG) Embora a reação de oxidação da celulose seja altamente exotérmica, (C6H10O5)n + 6nO2 → 6nCO2 + 5nH2O + calor um jornal, ou mesmo esta apostila (cujo papel é constituído essencialmente de celulose), pode ser lido ao ar livre ou mesmo numa câmara de oxigênio, sem se transformar. Em relação ao exposto, as seguintes afirmativas estão corretas, EXCETO:
A) A rapidez dessa reação é extremamente pequena.
B) Um aumento da pressão de oxigênio não influencia apreciavelmente a rapidez da reação.
C) Para a reação ocorrer, é necessário que seja vencida uma barreira de energia.
D) A rapidez de uma reação não depende da concentração dos reagentes.
E) Reações exotérmicas não são necessariamente espontâneas.
Questão 09. (UFPI–2006) Qual das sugestões para aumentar a velocidade de uma reação NÃO encontra suporte teórico na Teoria das Colisões?
A) Aumentar a concentração dos reagentes.
B) Reduzir o tamanho das partículas que devem reagir.
C) Dissolver os reagentes em um solvente.
D) Aumentar a temperatura.
E) Achar um catalisador apropriado.
Questão 10 sobre Teoria das Colisões e Complexo Ativado: (PUC RS) Para responder à questão, analise as afirmativas a seguir:
I. Uma reação com energia de ativação 40 kJ é mais lenta que uma outra reação que apresenta energia de ativação igual a 130 kJ.
II. A adição de um catalisador a uma reação química proporciona um novo “caminho” de reação, no qual a energia de ativação é diminuída.
III. Um aumento de temperatura geralmente provoca um aumento na energia de ativação da reação.
IV. A associação dos reagentes com energia igual à energia de ativação constitui o complexo ativado.
Pela análise das afirmativas, conclui-se que somente estão CORRETAS:
A) I e II.
B) I e III.
C) II e IV.
D) I, III e IV.
E) II, III e IV.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios de Química sobre Teoria das Colisões e Complexo Ativado:
01. B;
02. D;
03. B;
04. Soma = 06;
05. D;
06. B;
07. C;
08. D;
09. E;
10. C;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
