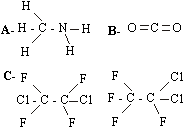Questão 01 sobre Fórmulas Químicas Moleculares: (Ufop MG/1999/2ªFase). Escreva a fórmula estrutural para cada fórmula molecular representada a seguir:
a) CH5N
b) CO2
c) C2Cl2F4
Questão 02. (Ufms MS/2008/Biológicas) A figura abaixo apresenta a curva de perda de massa em função de uma variação controlada de temperatura, para o sulfato de cobre hidratado, também conhecida como curva termogravimétrica.
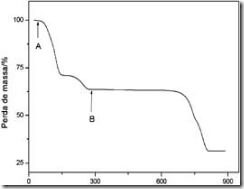
A perda de massa, ocorrida no intervalo de temperatura, limitado pelas setas A e B, corresponde à eliminação das moléculas de água de hidratação desse sal. O patamar, indicado pela letra A, corresponde a 100% em massa de amostra analisada. O patamar que se inicia na seta, indicada pela letra B, corresponde a 63,9% em massa e à porcentagem de sulfato de cobre anidro formado durante o processo. Sabendo-se que o CuSO4 tem massa molar igual a 159,62 g/mol e a H2O igual a 18,02 g/mol, calcule o número de moléculas de água no sulfato de cobre hidratado. (Caso necessário, aproxime o resultado para o inteiro mais próximo).
Questão 03. (ITA SP/2000). Certa substância foi aquecida em um recipiente aberto, em contato com o ar, numa velocidade de 10oC/min. A figura abaixo mostra, em termos percentuais, como varia a fração de massa residual remanescente no recipiente em função da temperatura.
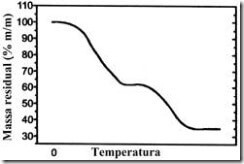
Qual das opções abaixo apresenta a substância, no estado sólido, que poderia apresentar tal comportamento?
a) CaCO3.
b) Ca(HCO3)2.
c) (NH4)2CO3.
d) CaSO4.
e) NH4HCO3
Questão 04 sobre Fórmulas Químicas Moleculares: (ITA SP/1999). Uma amostra de uma certa substância foi aquecida em um recipiente aberto e em contato com o ar. A curva abaixo representa, em termos percentuais, a fração de massa remanescente no recipiente em função da temperatura.
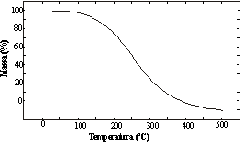
Das substâncias abaixo, qual poderia apresentar tal comportamento?
a) Uréia.
b) Sulfeto férrico.
c) Nitrato de cálcio.
d) Nitrato de alumínio.
e) Carbonato de sódio
Questão 05. (Uel PR/1990). Esta questão está relacionada com a amostra de uma substância que contém 12 g de C, 3 mols de átomos de H e 6,0 x 1023 átomos de O e cuja massa molecular é 62.
A fórmula molecular da substância é:
a) CH3O
b) C2H3O
c) C2H6O
d) C2H6O2
e) C3H9O3
Questão 06. (Unama AM/2001). O jornal “O Liberal”, de 22/10/2000, publicou a seguinte matéria:
SEM PÓDIO
O COI (Comitê Olímpico Internacional) vai punir mais um atleta que participou das Olimpíadas de Sidney – Austrália. (…) será o oitavo caso de “dopping” confirmado no jogos olímpicos de 2000.
Uma das substâncias químicas consideradas “dopping”, quando presente em doses elevadas na urina, é a cafeína.
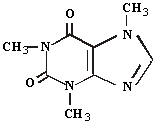
Em uma molécula desta substância os números de átomos de carbono e hidrogênio são, respectivamente, iguais a:
a) 7 e 9
b) 7 e 10
c) 8 e 9
d) 8 e 10
Questão 07 sobre Fórmulas Químicas Moleculares: (Vunesp SP/2000) A massa de 0,239g de um cloreto de alquila, quando vaporizada a 127oC e pressão de 1 atmosfera, ocupou um volume de 65,6 mililitros. Dados o volume molar do gás ideal (127oC, 1 atm) =32,8 L e massas molares, em g/mol: H =1,0; C =12,0; Cl =35,5, e considerando comportamento ideal para o vapor, pode-se dizer que a fórmula do haleto de alquila é:
a) CH3Cl
b) CH2Cl2
c) C4H4Cl2
d) CCl4
e) CHCl3
Questão 08. (Fesp PE).A pirita de ferro, conhecida como “ouro dos trouxas”, tem a seguinte composição centesimal: 46,67% de Fe e 53,33% de S. Sabe-se também que 0,01 mol de pirita tem massa correspondente a 1,20g. A fórmula que corresponde à pirita é:
Dados: Fe = 56u; S = 32u
a) FeS2
b) FeS
c) Fe2S
d) Fe2S3
e) Fe3S
Questão 09. (Puc camp SP) Em 0,5 mol de quinina, substância utilizada no tratamento da malária, há 120g de carbono, 12g de hidrogênio, 1,0 mol de átomos de nitrogênio e 1,0 mol de átomos de oxigênio. Pode-se concluir que a fórmula molecular da quinina é:
a) C20H12N2O2
b) C20H24N2O2
c) C10H12NO
d) C10H6N2O2
e) C5H6NO
Questão 10 sobre Fórmulas Químicas Moleculares: (Mackenzie SP). Fórmulas Químicas Moleculares: Na análise de 3,75g de um composto orgânico CxHYOw, encontrou-se 1,8g de carbono e 6×1022 átomos de oxigênio, além de hidrogênio. Se 0,75 mol desse composto pesa 112,5g, então sua fórmula molecular é:
Dadas as massas atômicas: C = 12u, H = 1u e O = 16u
a) C15H35O10
b) C6H14O4
c) C9H21O6
d) C12H9O4
e) C3H7O2
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as resposta dos exercícios sobre Fórmulas Químicas Moleculares:
02. 005;
03. Como podemos notar pela curva termogravimétrica houve a formação de um produto sólido termoestável no final do experimento o que sugere pelas substâncias representadas nas alternativas a formação do CaO. Logo, podemos dizer que a substância é um sal de cálcio. Então temos a relação:
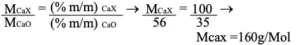
Assim, o sal é o Ca(HCO3)2 que tem M = 162 g/mol.
04. A
RESOLUÇÃO:
– Todos os compostos citados são iônicos, exceto a uréia. Quando decompomos compostos iônicos, mesmo a elevadas temperaturas, em recipientes abertos , haverá formação de novos compostos e portanto a massa não tenderia a zero.
– Como podemos observar no gráfico que a massa tende a zero, podemos afirmar que a decomposição foi da uréia, que formará substâncias como CO2 e NH3, ambas gasosos, fazendo com que a massa tenda a zero no final do processo.
05. D;
06. D;
07. E;
08. A;
09. B;
10. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína