Questão 01 sobre Cálculo de Fórmulas Químicas: (Unirio/2000) O etileno glicol, substância muito usada como agente anticongelante em motores automotivos, é um álcool e possui 38,7% de C, 9,7% de H e 51,6% de O. A fórmula mínima deste composto é (Massas atômicas: H = 1 u; C = 12 u; O = 16 u.):
a) CHO3.
b) CH3O.
c) CH3O2.
d) C2H3O.
e) C3HO.
Questão 02. (PUC-Rio/2004) A fórmula mínima de um composto orgânico é (CH2O)n. Sabendo-se que o peso molecular desse composto é 180, qual o valor de n?
a) 2.
b) 4.
c) 6.
d) 8.
e) 12.
Questão 03. (UFF/2002) No combate à dor e à febre, um medicamento muito utilizado é a Aspirina, cuja composição centesimal é:
C = 60,00%, H = 4,44% e O = 35,56%.
Sabendo-se que em uma amostra de aspirina com 0,18 g de massa existem 6,02 × 1020 moléculas, conclui-se que a fórmula molecular desse composto é:
a) C9H6O3.
b) C8H4O5.
c) C10H12O3.
d) C9H8O4.
e) C9H8O4.
Questão 04 sobre Cálculo de Fórmulas Químicas: (UFRRJ/04) Os sais de cobre são conhecidos por apresentarem coloração azul, inclusive sendo utilizados em misturas destinadas a tratamento de água em piscinas. O sulfato cúprico pentaidratado apresenta uma percentagem de água de, aproximadamente, (Dados: Cu = 63,5; S = 32, O = 16; H = 1.)
a) 23,11%.
b) 55,34%.
c) 89,09%.
d) 36,07%.
e) 76,22%.
Questão 05. (UFG/2003) O Parque Nacional das Emas, localizado no extremo sudoeste do Estado de Goiás, é caracterizado pelo agrupamento de cupinzeiros, que servem como local de desenvolvimento de larvas de vaga-lumes. Pela emissão de luz, elas atraem outros insetos que lhes servem de alimento. Esse fenômeno de emissão de luz é chamado de bioluminescência e ocorre, principalmente, pela oxidação de uma substância química conhecida por luciferina, representada a seguir:
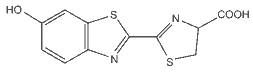
Determine a fórmula molecular, a massa molecular e a composição percentual da luciferina.
Dados: O = 16; H = 1; C = 12; N = 14; S = 32.
Questão 06. (UFF/2001) Para se determinar o percentual de Ca2+ presente em amostra de leite materno, adiciona-se íon oxalato, na forma de Na2C2O4 à amostra, o que provoca precipitação de CaC2O4.
A adoção do procedimento descrito, em determinada amostra de leite materno com 50,0 g de massa, originou 0,192 g de CaC2O4. Deduz-se, então, que o percentual de Ca2+ nesta amostra equivale a (Dados: Massas molares (g/mol): Ca = 40,0; C = 12,0; O = 16,0.)
a) 0,12%.
b) 0,24%.
c) 0,50%.
d) 1,00%.
e) 2,00%.
Questão 07 sobre Cálculo de Fórmulas Químicas: (UFPB/07) O zinco é um elemento químico considerado essencial para a vida, uma vez que faz parte da constituição de diversas enzimas e é requisitado na síntese de proteínas e do DNA. Um composto desse elemento, o sulfato de zinco, é encontrado comumente na sua forma hidratada (ZnSO4. xH2O) e, nessa forma, tem amplo uso veterinário. Esse sal, quando aquecido à temperatura aproximada de 120°C, perde 43,9% de sua massa.
O número de moléculas de água de hidratação desse sal é:
a) 2.
b) 3.
c) 5.
d) 6.
e) 7.
Questão 08. (UFF/07) O esmalte dos dentes contém um mineral chamado hidroxiapatita – Ca5(PO4)3OH. Os ácidos presentes na boca, ao reagirem com a hidroxiapatita, provocam o desgaste do esmalte, originando as cáries. Atualmente, com o objetivo de prevenção contra as cáries, os dentifrícios apresentam em suas fórmulas o fluoreto de cálcio. Este é capaz de reagir com a hidroxiapatita, produzindo a fluorapatita – Ca5(PO4)3F – uma substância que adere ao esmalte, dando mais resistência aos ácidos produzidos, quando as bactérias presentes na boca metabolizam os restos de alimentos.
Com base nas fórmulas mínimas das duas substâncias, pode-se afirmar que o percentual de fósforo nos compostos é, aproximadamente:
a) 0,18%.
b) 0,60%.
c) 6,00%.
d) 18,50%.
e) 74,0%.
Questão 09. (PUC-PR/2010) Está registrado na Bíblia, em Levíticos, que as folhas e galhos do salgueiro que nasce nos riachos são medicinais. Há 2400 anos, Hipócrates já recomendava folhas de salgueiro para doenças e trabalhos de parto. Hoje, a aspirina – ácido acetilsalicílico – é a droga mais popular em todo o mundo. Estima-se que já tenham sido consumidos 1 × 1012 tabletes de aspirina. A cada ano, 50.000 tabletes de aspirina são vendidos mundialmente – isto sem contar as outras formas, como o AAS, que aparece no mercado, quer seja em outras marcas da aspirina ou, ainda, combinado com outros analgésicos, cafeína ou vitamina C. Registrada sob a patente no. 36433 de Berlim, em 1899, a aspirina superou gerações e continua sendo a droga mais utilizada no combate à dor – e a cada ano surgem mais indicações para esse fármaco.
Fonte: www.qmcweb.org.
A aspirina tem 60 % de carbono, 4,5 % de hidrogênio e 35,5 % de oxigênio. Determine a sua fórmula empírica. Dados: C = 12, H = 1, O = 16:
a) C5H4O2.
b) C9H8O4.
c) C2H2O1.
d) CHO.
e) C18H16O8 .
Questão 10 sobre Cálculo de Fórmulas Químicas: (UFU/2010)
O cara chegou na praia com o seu bermudão
todo inchado até a mente, se achando o tremendão
azarou uma gatinha, pra ela disse assim
isso é muita malhação e deca-durabolim
tomar bomba é muito bom, fica forte e animal
o único problema é o efeito colateral
ele tem picape e um cordãozão de ouro […].
(Música: Bermuda Florida, Mr. Catra)
A letra do funk carioca acima diz respeito ao anabolizante injetável Deca-durabolim, produto da indústria farmacêutica comercializado em caixas de 25 mg e 50 mg do decanoato de nandrolona (C18H26O2), substância proibida para atletas profissionais, sob pena de dopping. Sobre essa substância, assinale a alternativa INCORRETA.
a) A massa de carbono presente em uma caixa de 25 mg de decanoato de nandrolona é, aproximadamente, 20 mg.
b) A massa de um mol de decanoato de nandrolona é 274 g.
c) A fórmula mínima do decanoato de nandrolona é C9H13O.
d) Um indivíduo de 70 kg que utilizar uma vez por semana Deca-durabolim 50 mg terá, ao final de um mês (quatro semanas), injetado 1,5 mg de decanoato de nandrolona por quilograma corpóreo.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química para Enem sobre Cálculo de Fórmulas Químicas:
01. b;
02. c;
03. d;
04. d;
05. Fórmula molecular: C11H8S2N2O3
Massa molecular: 280 u
Composição percentual:
C ……… 47,14%
H ……… 2,86%
S ……… 22,86%
N ……… 10,00%
O ……… 17,14%
06. a;
07. e;
08. d;
09. b;
10. d
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
