Questão 01 sobre Fórmula Química Centesimal: (Ufg GO/2000/1ªFase). A dioxina é um contaminante altamente tóxico, obtido como subproduto na produção de alguns herbicidas. Sua fórmula estrutural plana é
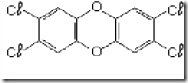
01. e sua fórmula molecular é C12H4Cl4O2.
02. e faz ponte de hidrogênio entre suas moléculas.
03. e apresenta, na sua composição centesimal, teores de carbono e oxigênio superiores a 40% e 15%, respectivamente.
04. e sofre hidrogenação catalítica, reagindo na proporção de uma parte de dioxina para seis partes de oxigênio.
Questão 02. (Vunesp SP/1996). A porcentagem em massa de carbono no clorofórmio, CHCl3 , é (massas molares, em g/mol: H = 1; C = 12, Cl = 35,5):
a) 1%
b) 10%
c) 12%
d) 24%
e) 50%
Questão 03 sobre Fórmula Química Centesimal: (Uff RJ/1996/1ªFase) Atualmente, os joalheiros estão utilizando uma liga metálica de Ag / Cu, para confeccionar algumas jóias. Um bracelete de massa 17,6g que contém 14,g de Ag apresenta, na sua composição, os seguintes percentuais de Ag e Cu, respectivamente:
a) 82,4 e 17,6
b) 19,9 e 80,1
c) 85,9 e 14,1
d) 80,1 e 19,9
e) 37,7 e 68,3
Questão 04. (Uftm MG/2006/2ªFase) A revolução de implantes dentários e de próteses se deve ao sueco P.I. Bränemark que fundou uma clínica no Brasil para tornar esse tratamento acessível a populações mais carentes. A osseointegração é uma técnica de implantação de titânio praticamente irremovível em que o metal, na forma de pinos, integra-se ao osso, podendo sustentar dentes, orelhas, mãos, rostos e outras partes do corpo. O titânio na sua forma de óxido é extraído do mineral ilmenita. O óxido de titânio(IV), quando aquecido com coque, C(s), e gás cloro, produz somente o tetracloreto de titânio e o dióxido de carbono. O TiCl4 é reduzido a titânio metálico após tratamento com magnésio metálico.
a) Escreva as equações, devidamente balanceadas, que representam as reações de obtenção do titânio metálico a partir de seu óxido.
b) A integração do titânio ao osso deve-se, possivelmente, à formação da hidroxiapatita, principal mineral do osso, sobre a superfície do metal, o que o torna parte integrante do osso. Apresente a dedução da fórmula empírica da hidroxiapatita, que apresenta composição centesimal em massa aproximadamente igual a:
40% de Ca2+, 57% de ![]() e 3,4% de OH–.
e 3,4% de OH–.
Dados: massas molares (g/mol)
Ca2+ = 40,
OH– = 17
Questão 05 sobre Fórmula Química Centesimal: (IME RJ/2001). Uma mistura de sulfeto de zinco e sulfeto de antimônio III pesa 2,0g. Esta mistura é tratada com ácido clorídrico em excesso e os gases resultantes passam através de um tubo aquecido e revestido internamente com dióxido de chumbo. Sabendo-se que ocorre um aumento de massa no tubo de 0,2965g, determine a composição da mistura.
Dado: 2H2S + PbO2 à 2H2O(g) + PbS2(s)
Questão 06. (Fuvest SP). Hidrogênio reage com quase todos os elementos. Sua reação com nitrogênio produz amônia (NH3). Industrialmente essa reação é realizada na presença de um catalisador.
a) Explique para que serve o catalisador.
b) Calcule a percentagem em massa de hidrogênio na amônia.
Questão 07. (Ucg GO/1990/Julho) A Penicilina G, um antibiótico largamente utilizado, tem fórmula C16H18N2O4S. Qual a porcentagem de carbono na Penicilina G?
Questão 08 sobre Fórmula Química Centesimal: (Uec CE/1999/Janeiro) Quando aquecemos 1,63g de Zn, este se combina com 0,4g de oxigênio para formar um óxido de zinco. A composição porcentual do composto é:
a) 83,0% de Zn e 17,0% de oxigênio
b) 80,3% de Zn e 19,7% de oxigênio
c) 20,0% de Zn e 80,0% de oxigênio
d) 40,0% de Zn e 60,0% de oxigênio
Questão 09. (Vunesp SP/1993) As substâncias indicadas abaixo são de grande importância como fertilizantes porque fornecem nitrogênio. Indique qual delas é potencialmente a mais rica fonte desse elemento. (Massas Atômicas: H = 1; C = 12; N = 14; S = 32; K = 39)
a) uréia, CO(NH2)2
b) nitrato de amônio, NH4NO3
c) sulfato de amônio, (NH4)2SO4
d) guanidina, HCN(NH2)2
e) nitrato de potássio, KNO3
Questão 10 sobre Fórmula Química Centesimal: (Aman RJ/1990). Uma argila apresenta 45% de sílica e 10% de umidade. Se secarmos completamente essa argila, o teor de sílica será:
a) 90%
b) 50%
c) 45%
d) 55%
e) 100%
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios de Fórmula Química Centesimal:
01. 01-C; 02-E; 03-E; 04-E
02. B;
03. D;
04. a) TiO2 + 1C(s) + 2Cl2(g) ![]() TiCl4(s) + CO2(g)
TiCl4(s) + CO2(g)
TiCl4(s) + 2Mg(s) ![]() Ti(s) + MgCl2(s)
Ti(s) + MgCl2(s)
b) Ca5(PO4)3OH
05. Para formação de um mol de sulfeto de chumbo a partir de óxido de chumbo temos um incremento de massa igual a 31,8g.
Δm = 271,2 – 239,4 = 31,8g/mol
1molPbS2 _______________ 31,8g
x _______________ 0,3965g
x = 0,009mol PbS2
O que equivale a: y = 0,09 x 271,2 = 2,53g PbS2
Porcentagem de S em PbS2:
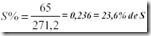
Ou seja, na amostra temos: Z = 23,6% x 2,53 = 0,596g de S.
Calculemos agora as quantidades de ZnS (a) e Sb2S3 (b)
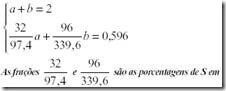
ZnS e Sb2S3 respectivamente, o que deve ser igual a quantidade de S encontrada em H2S que é a mesma em PbS2.
a = 0,72g e b = 1,28g
Então as porcentagens são: ZnS = 36% e Sb2S3 = 64%
06. a) aumentar a velocidade da reação
b) 17,65% de H
07. 57,48% de C;
08. B;
09. D;
10. B;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
