Questão 01. (Mackenzie) Aplicando-se o conceito de ácido-base de Brönsted-Lowry à reação abaixo equacionada, verifica-se que:

Questão 02. (UFSC) Svante Arrhenius, ao formular sua teoria sobre ácidos e bases, considerou exclusivamente:
(01) meio aquoso (o solvente é a água).
(02) dissociação de eletrólitos com liberação de íons H1+(H3O1+) ou OH-.
(04) todo e qualquer meio não aquoso.
(08) as espécies químicas deficientes de elétrons, chamando-as de ácido.
(16) as espécies químicas com pares eletrônicos disponíveis, chamando-as de bases.
Soma ( )
Questão 03. (Unicamp) Sabendo-se que o nitrogênio, N, tem cinco elétrons em sua camada de valência:
a) Represente, de forma esquemática, a estrutura eletrônica (fórmula eletrônica ou de Lewis) da amônia, NH3, indicando cada par eletrônico por dois pontos (:).
b) Observando a estrutura esquematizada, que propriedades, ácidas ou básicas, pode-se esperar que a amônia apresente? Justifique.
Questão 04 sobre Funções Inorgânicas: (UEL) De acordo com a definição de ácidos e bases, segundo Lewis, uma das afirmações abaixo é certa. Escolha.
a) Ácidos são substâncias que captam um par de elétrons, enquanto as bases são substâncias doadoras de pares de elétrons.
b) Ácidos são substâncias doadoras de prótons; bases são substâncias receptoras de prótons.
c) Ácidos são substâncias doadoras de nêutrons; bases são substâncias receptoras de nêutrons.
d) Ácidos são substâncias receptoras de nêutrons; bases são substâncias doadoras de nêutrons.
e) Ácidos são substâncias que em solução aquosa produzem íon H1+; bases são substâncias que em solução aquosa produzem íon OH1-.
Questão 05. (UFF) Questões sobre Funções Inorgânicas: Sabe-se que em água, alguns ácidos são melhores doadores de prótons que outros e algumas bases são melhores receptoras de prótons que outras. Segundo Brönsted, por exemplo, o HCl é um bom doador de prótons e considerado um ácido forte. De acordo com Brönsted, pode-se afirmar:
a) Quanto mais forte a base, mais forte é seu ácido conjugado.
b) Quanto mais forte o ácido, mais fraca é sua base conjugada.
c) Quanto mais fraco o ácido, mais fraca é sua base conjugada.
d) Quanto mais forte a base mais fraca é sua base conjugada.
e) Quanto mais forte o ácido mais fraco é seu ácido conjugado.
Questão 06. (Cescem) Seja a seguinte tabela:
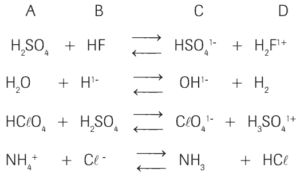
Na série de reações apresentadas, podemos fazer a seguinte generalização.
a) São ácidas somente as substâncias da coluna A.
b) São ácidas somente as substâncias da coluna B.
c) São ácidas somente as substâncias das colunas A e B.
d) São ácidas somente as substâncias das colunas A e D.
e) Nenhuma das generalizações acima é correta.
Questão 07 sobre Funções Inorgânicas: (UFF) De acordo com as seguintes reações:
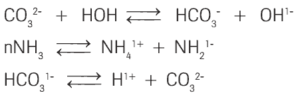
A espécie química que satisfaz tanto ao critério de Arrhenius quanto ao de Brönsted-Lowry para ser considerada um ácido é:
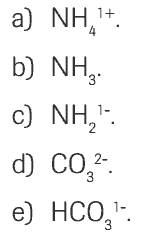
Questão 08. (UGF) Quando o HC gasoso é dissolvido em água, forma-se o equilíbrio representado por:
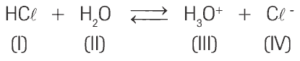
Usando os numerais romanos para cada fórmula, quais destas combinações representam duas bases?
a) I e III.
b) I e IV.
c) II e III.
d) II e IV.
e) III e IV.
Questão 09. (UEL) A partir da fórmula de um ácido chegamos à fórmula de sua base conjugada:
a) somando um H1+.
b) subtraindo um H1+.
c) subtraindo um H1+ e somando um OH1-.
d) somando um H3O1+.
e) subtraindo um H 3O1+.
Questão 10 sobre Funções Inorgânicas: (Unirio) O BF3 é um ácido de Lewis, porque pode:
a) doar um par de elétrons.
b) doar um elétron.
c) receber um elétron.
d) receber um par de elétrons.
e) em solução aquosa libertar HF.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das Questões sobre Funções Inorgânicas: Ácidos e Bases:
01. B;
02. 01;
03. a)
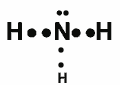
b) Base de Lewis: oferece o compartilhamento de par de elétrons.
04. A;
05. B;
06. D;
07. E;
08. D;
09. B;
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
