Questão 01 sobre Hidrólise Salina: (IME) A constante de ionização de um ácido monocarboxílico de massa molecular 60 é 4,0 . 10-5. Dissolvem–se 6,0g desse ácido em água até completar 1 litro de solução.
Determine:
a) a concentração de H+ na solução,
b) o pH da solução,
c) a expressão matemática da constante de ionização,
d) a concentração de H+ se o ácido for totalmente ionizado,
e) a solução que neutralizará uma maior quantidade de NaOH, considerando duas soluções, de mesmo volume e de mesmo pH, do ácido monocarboxílico e de HCl.
Questão 02. (UERJ) A amônia anidra é um gás incolor de odor intenso. Quando dissolvida em água, recebe o nome de
hidróxido de amônio.
a) Calcule o pH da solução de hidróxido de amônio 0,05mol . L-1, nas condições ambientes.
Considere, em seu cálculo, o valor da constante de ionização da amônia igual a 2,0 . 10-5 e despreze a auto–ionização da água.
b) Escreva o nome da forma geométrica da molécula da amônia e classifique o tipo de ligação interatômica nela presente, a partir da diferença de eletronegatividade.
Questão 03. (Cesgranrio) Existe na Terra uma imensa variedade de nichos ecológicos, alguns deles considerados bastante inóspitos aos quais os organismos se adaptaram através do processo de seleção natural. Organismos adaptados a ambientes que possuem condições extremas são chamados de extremófilos. A alga Cyanidium aldarium, por exemplo, consegue crescer em soluções concentradas de ácido sulfúrico quente. Outras bactérias, algas e fungos podem viver em ambientes extremamente ácidos (pH próximo de zero) ou extremamente alcalinos (pH próximo de 13). Algumas bactérias chamadas de termófilas como Thermus aquaticus têm crescimento ótimo em ambientes com temperatura de 70°C.
No texto, pode–se facilmente verificar a importância do estudo do pH, em associação ao crescimento de bactérias, algas e fungos em meios ácidos ou básicos. Considerando–se que um bioquímico preparou dois meios de cultura (X) ou (Y) com pH iguais, respectivamente, a 2 e 12, está correto afirmar que:
a) (Y) é mais ácido que (X).
b) o pOH em (X) é igual ao pOH em (Y).
c) a concentração hidrogeniônica em (X) é igual à concentração hidroxiliônica em (Y).
d) a concentração hidrogeniônica em (X) é igual à concentração hidrogeniônica em (Y).
e) a concentração hidrogeniônica em (X) é igual ao pH em (Y).
Questão 04 sobre Hidrólise Salina: Modelo Enem. Em um potenciômetro, se faz a leitura de uma solução 0,001M de hidróxido de sódio (utilizado na neutralização do ácido lático). Sabendo–se que o grau de dissociação é total, o valor do pH encontrado corresponde a:
a) 2,7
b) 5,4
c) 12,0
d) 11,0
e) 9,6
Questão 05. (UFRJ) “Piero Volpi, o médico do lnternazionale de Milão, afirmou ontem, em depoimento perante o promotor Raffaele Guariniello, de Turim, que Ronaldinho pode ter sofrido uma crise convulsiva no dia da decisão da Copa do Mundo, devido ao uso contínuo do antiinflamatório Voltaren para recuperação de seu problema nos joelhos. Tal hipótese já havia sido levantada por Renato Maurício
Prado em sua coluna no Globo do dia 15 de julho”. (O Globo, 2 out. 1998.)
A literatura médica dá sustentação às suspeitas do médico do lnter, pois relata vários efeitos colaterais do diclofenaco de sódio (princípio ativo deste e de vários outros antiinflamatórios), especialmente quando utilizado em associação a analgésicos comuns como, por exemplo, o ácido acetilsalicílico (AAS).
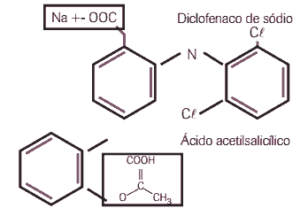
a) Identifique as funções químicas destacadas por meio de retângulos nas estruturas do diclofenaco de sódio e do ácido acetilsalicílico (AAS).
b) Sabendo que o ácido acetilsalicílico é um ácido fraco, calcule a concentração de íons hidrogênio e de íons hidroxila em uma solução diluída de AAS que apresenta pH = 5.
Questão 06. (Cesgranrio) Certa marca de vinagre indica em seu rótulo 6% em massa por volume de ácido acético (etanóico). Sabendo–se que ele se encontra 2% ionizado, o seu pH será: (Dado: log 2 = 0,3)
a) 0,7
b) 1,3
c) 1,7
d) 2,3
e) 5,7
Questão 07 sobre Hidrólise Salina: (UERJ) Na “guerra” do mercado de sabonetes infantis, é comum a expressão: “pH neutro não agride a pele do bebê”. Esta frase estará quimicamente correta quando o valor do pH, a 25°C, for igual a:
a) 14
b) 10
c) 7
d) 0
Questão 08. (UERJ) O controle do pH do sangue humano é um processo complexo que envolve o cérebro, os pulmões e os rins. Neste processo, o íon hidrogenocarbonato desempenha uma importante função tamponante. Considerando as condições ambientes e a concentração hidroxiliônica equivalente a 2,5 . 10-7 mol . L-1, calcule o pH do sangue humano. Utilize Log105 igual a 0,70.
Questão 09. (UERJ) O etanoico é uma substância de largo emprego na indústria de alimentos, seja como conservante, seja para consumo na forma de vinagre. Uma solução de etanoico 0,1mol . L– apresenta um pH de, aproximadamente, 3. Considerando as condições ambientes, calcule o valor do grau de ionização do etanoico e a concentração de íons etanoato no estado de equilíbrio, em g . L-1.
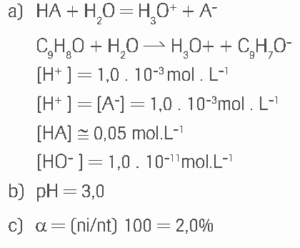
Questão 10 sobre Hidrólise Salina: (UFF) O princípio ativo da aspirina é o ácido acetilsalicílico (AAS, C 9H8O4), que é um ácido fraco monocarboxílico, de Ka igual a 2,0 . 10-5 a 27°C. Considere uma solução aquosa de aspirina que apresenta concentração de 0,05mol . L-1 e determine:
a) a concentração de cada espécie presente;
b) o pH;
c) o grau de ionização (α).
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado sobre Hidrólise Salina:
01.
a) [H+ ] = 2,0 . 10–3mol/l
b) pH = 2,7
c) Ki = [H+][R – COO–]/[R – COOH]
d) [H+] = 0,1mol/l
e) A solução do ac. monocarboxílico. Neutralizará maior quantidade de base.
02. a) 11
b) Geometria piramidal.
c) Ligação covalente.
03. C;
04. D
05. a) Sal e éster, respectivamente.
[Hb) +] = 10-5 [OH– ] = 10-9
06. C;
07. C;
08. 7,4
09. α = 1%
0,059g . L–1
10.
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
