Questão 01 Ligações Iônicas Questões: (UFMG) Com relação aos íons K+ e Cl–, é INCORRETO afirmar que:
A) ambos apresentam o mesmo número de elétrons que o átomo de argônio.
B) o ânion Cl– é maior que o átomo neutro de cloro.
C) o átomo neutro de potássio absorve energia para se transformar no cátion K+.
D) um elétron é transferido do Cl– para o K+, quando esses íons se ligam.
Questão 02. (PUC Minas) O gráfico a seguir se refere a dois íons de cargas contrárias em equilíbrio.
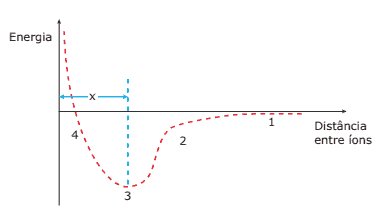
Todas as afirmativas são corretas, EXCETO:
A) O comprimento de ligação é a distância x.
B) Os íons se encontram isolados no ponto 1.
C) Os íons estão em equilíbrio no ponto 3.
D) A menor estabilidade ocorre no ponto 3.
E) As forças de repulsão prevalecem no ponto 4.
Questão 03 Ligações Iônicas Questões: (UFMG) A figura representa uma seção plana de um cristal iônico, como Na+Cl–(s) ou Ca2+O2–(s). Os íons foram numerados para facilitar a sua identificação.
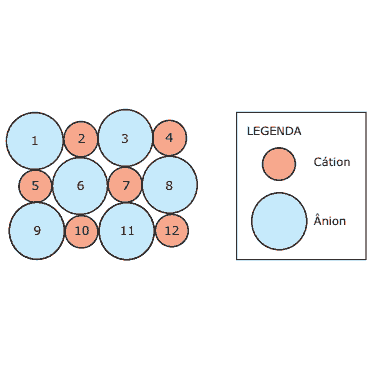
Considerando-se o modelo de ligação para compostos iônicos e os íons representados, é CORRETO afirmar que :
A) o ânion 6 apresenta ligações iônicas de mesma força com os cátions 2, 5, 7 e 10.
B) o par de íons 2-6, no caso do cristal de Ca2+O2–, está ligado por duas ligações iônicas.
C) o ânion 1 não apresenta interação eletrostática com o cátion 7.
D) o par de íons 1-5 está ligado ao par de íons 2-6 por uma interação entre dipolos permanentes.
Questão 04. (Unimontes-MG–2009) O osso tem como um de seus constituintes o fostato de cálcio, Ca3(PO4)2, responsável por sua rigidez. A estrutura de Lewis desse composto é mostrada a seguir:
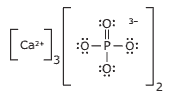
Relacionando as ligações químicas presentes nesse composto com as propriedades do osso, é CORRETO afirmar que:
A) as ligações químicas presentes nos íons de fosfato tornam o osso mais quebradiço.
B) as atrações eletrostáticas entre os íons Ca2+ e PO43- conferem alta rigidez ao osso.
C) o osso tem alta solubilidade em água por apresentar ligações químicas iônicas.
D) as cargas bi e trivalentes, nos respectivos íons, não influenciam na rigidez do osso.
Questão 05 Ligações Iônicas Questões: (ITA-SP) Uma determinada substância apresenta as seguintes propriedades físico-químicas:
I. O estado físico mais estável a 25 ºC e 1 atm é o sólido.
II. No estado sólido apresenta estrutura cristalina.
III. A condutividade elétrica é praticamente nula no estado físico mais estável a 25 ºC e 1 atm.
IV. A condutividade elétrica é alta no estado líquido.
A alternativa relativa à substância que apresenta todas as propriedades anteriores é o(a):
A) poliacetileno (C2H2)n.
B) brometo de sódio (NaBr).
C) iodo (I2).
D) silício (Si).
E) grafita (C).
Questão 06. (UFMG–2006) O cloreto de sódio, NaCl, é um composto iônico solúvel em água. Sua dissolução pode ser assim representada:
Dissolução do cristal: NaCl(s) → Na+(aq) + Cl–(aq)
Esse processo também pode ser representado, formalmente, em duas etapas:
I. Dissociação do cristal: NaCl(s) → Na+(g) + Cl–(g)
II. Solvatação dos íons: Na+(g) + Cl–(g) H2O Na+(aq) + Cl–(aq)
Considerando-se essas etapas da dissolução do cristal, é CORRETO afirmar que:
A) na etapa da solvatação dos íons do cloreto de sódio, ocorre liberação de energia.
B) na água pura, as interações entre as moléculas são mais fortes que as interações entre os íons no cristal.
C) na solução de cloreto de sódio, as moléculas de água estabelecem ligações de hidrogênio com os íons sódio.
D) na etapa da dissociação do cloreto de sódio, a energia do retículo cristalino é liberada.
Questão 07 Ligações Iônicas Questões: (UFMG) Recentemente, os químicos têm investigado uma nova classe de materiais – os líquidos iônicos. A novidade desses materiais é que, nas condições ambientais, as substâncias iônicas mais comuns são sólidas. A estrutura exemplifica um líquido iônico:
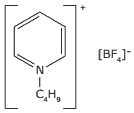
Essa substância tem propriedades interessantes:
• É líquida, nas condições ambiente.
• É solúvel em água.
• É um bom solvente para muitas substâncias polares e apolares.
A) Com base nas características estruturais dessa substância, JUSTIFIQUE o fato de ela ser um bom solvente para muitas substâncias apolares.
B) ANALISE a estrutura dessa substância e, com base na interação eletrostática entre seu cátion e seu ânion, JUSTIFIQUE o fato de ela ser líquida.
Questão 08. (UNIRIO-RJ–2006) De acordo com a Lei de Coulomb, a força de atração entre partículas de cargas opostas é diretamente proporcional às suas cargas e inversamente proporcional ao quadrado das distâncias entre eles.
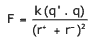
Onde q’ e q são as cargas dos íons, r+ e r– são os raios dos íons e k é uma constante. COMPARE os compostos MgO e BaO, quanto aos seus pontos de fusão, sabendo-se que os raios iônicos do Ba2+ e Mg2+ são, respectivamente, 1,35 A° e 0,65 A°.
Questão 09. (UEL-PR) Considere as propriedades:
I. Elevado ponto de fusão
II. Brilho metálico
III. Boa condutividade elétrica no estado sólido
IV. Boa condutividade elétrica em solução aquosa
São propriedades características de compostos iônicos:
A) I e II.
B) I e IV.
C) II e III.
D) II e IV.
E) III e IV.
Questão 10 Ligações Iônicas Questões: (FUVEST-SP) Os átomos dos metais alcalinoterrosos (M) apresentam dois elétrons em sua camada de valência. É de se prever que os óxidos e os cloretos desses metais tenham, respectivamente, as fórmulas mínimas:
A) MO e MCl2.
B) MO e MCl.
C) MO2 e MCl.
D) MO2 e MCl4.
E) M2O e MCl2.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com 10 questões de química sobre Ligações Iônicas Questões:
01. D;
02. D;
03. A;
04. B;
05. B;
06. A;
07. A) O composto possui íons com cadeias apolares que podem solvatar moléculas apolares, interagindo com elas por meio de ligações do tipo dipolo instantâneo-dipolo induzido.
B) O fato de cátions e ânions serem muito grandes faz com que a força de interação entre eles seja menor que na maioria dos compostos iônicos.
08. O MgO apresenta maior ponto de fusão em relação ao BaO, já que o maior raio deste faz com que haja diminuição da intensidade da força atrativa na rede cristalina. As cargas dos íons Ba2+ e Mg2+são equivalentes, então não influenciam na diferença dos pontos de fusão.
09. B;
10. A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
