Questão 01. (VUNESP) Exercícios sobre Termoquímica: Em uma cozinha, estão ocorrendo os seguintes processos:
I. Gás queimando em uma das “bocas” do fogão.
II. Água fervendo em uma panela que se encontra sobre essa “boca” do fogão.
Com relação a esses processos, pode-se afirmar que:
A) I e II são exotérmicos.
B) I é exotérmico e II é endotérmico.
C) I é endotérmico e II é exotérmico.
D) I é isotérmico e II é exotérmico.
E) I é endotérmico e II é isotérmico.
Questão 02. (FUVEST-SP) Nas condições ambiente, ao inspirar, puxamos para nossos pulmões, aproximadamente, 0,5 L de ar, então aquecido da temperatura ambiente (25 ºC) até a temperatura do corpo (36 ºC). Fazemos isso cerca de 16×103 vezes em 24h. Se, nesse tempo, recebermos, por meio da alimentação, 1,0×107 J de energia, a porcentagem aproximada dessa energia, que será gasta para aquecer o ar inspirado, será de Dados: Ar atmosférico nas condições ambiente:
densidade = 1,2 g.L-1;
calor específico = 1,0 J.g-1.ºC-1.
A) 0,1%.
B) 0,5%.
C) 1%.
D) 2%.
E) 5%.
Questão 03. (Enem–2000) Exercícios sobre Termoquímica: Ainda hoje, é muito comum as pessoas utilizarem vasilhames de barro (moringas ou potes de cerâmica não esmaltada) para conservar água a uma temperatura menor do que a do ambiente. Isso ocorre porque:
A) o barro isola a água do ambiente, mantendo-a sempre a uma temperatura menor que a dele, como se fosse isopor.
B) o barro tem poder de “gelar” a água pela sua composição química. Na reação, a água perde calor.
C) o barro é poroso, permitindo que a água passe através dele. Parte dessa água evapora, tomando calor da moringa e do restante da água, que são assim resfriadas.
D) o barro é poroso, permitindo que a água se deposite na parte de fora da moringa. A água de fora sempre está a uma temperatura maior que a de dentro.
E) a moringa é uma espécie de geladeira natural, liberando substâncias higroscópicas que diminuem naturalmente à temperatura da água.
Questão 04. (Enem) Os conceitos de calor e temperatura são fundamentais no estudo da Termoquímica. No entanto, há ainda muita confusão sobre eles quando são usados na linguagem cotidiana. Os itens que se seguem procuram relacionar esses conceitos e suas aplicações.
1. A queimadura causada por 10 gramas de vapor de água a 100 ºC é muito mais grave do que a ocasionada pela mesma quantidade de água, também a 100 ºC, visto que, na mudança de estado de vapor para líquido, há liberação de grande quantidade de energia térmica.
2. A sensação de frio que temos ao pegar a maçaneta de metal de uma porta está relacionada ao fato de o metal ser um bom condutor de calor. Então, nossa pele perde calor para a maçaneta.
3. Quando um objeto ganha ou perde calor, sua temperatura se altera. Porém, é plenamente possível que a temperatura desse objeto seja alterada sem o envolvimento de calor.
4. No inverno, usamos, de preferência, roupas de lã (de cores escuras) porque, em virtude da composição química desta, há uma constante troca de calor entre a lã e o corpo da pessoa.
Os itens corretos são:
A) 1 e 2.
B) 2 e 3.
C) 3 e 4.
D) 1 e 4.
E) 1 e 3.
Questão 05. (Enem) Exercícios sobre Termoquímica: A febre se caracteriza por um aumento da temperatura do corpo. Em caso de infecção, inflamação ou determinadas doenças, a temperatura do corpo pode aumentar. Trata-se, então, de uma reação de defesa do organismo frente aos agressores. Os efeitos do álcool (etanol) na pele intacta levaram muitos pais a usá-lo como um remédio caseiro rápido contra a febre em crianças pequenas. Isso ocorre porque:
A) o álcool, por ser “frio”, ao entrar em contato com a pele, ajuda a reduzir a temperatura corporal.
B) o álcool, quando esfregado na pele, tem o poder de “gelar” a pele, devido à sua composição química, reduzindo a temperatura corporal.
C) o álcool, quando esfregado na pele, evapora, retirando calor da pele, o que reduz potencialmente a temperatura corporal.
D) o álcool, por ser bastante volátil, ao entrar em contato com a pele, evapora, liberando calor para o ambiente, o que facilita a redução da temperatura corporal.
E) o álcool é absorvido pela pele, interage com a água e facilita a perda de líquido, o que ajuda a reduzir a temperatura corporal.
Questão 06. (PUC RS) Considerando-se as transformações
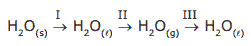
conclui-se que ocorre transformação endotérmica apenas em:
A) I.
B) II.
C) III.
D) I e II.
E) II e III.
Questão 07. (FUVEST-SP–2007) Exercícios sobre Termoquímica: A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico. Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que se segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo Na+(aq) e Cl-(aq).
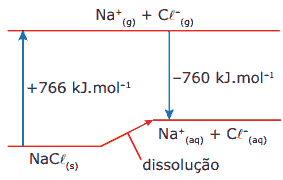
s = sólido aq = aquoso g = gasoso
Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal:
A) é acentuadamente exotérmica, envolvendo cerca de 103 kJ.
B) é pouco endotérmica, envolvendo menos de 10 kJ.
C) ocorre sem troca de calor.
D) é pouco exotérmica, envolvendo menos de 10 kJ.
E) é acentuadamente endotérmica, envolvendo cerca de 103 kJ.
Questão 08. (Enem–2009) Além de ser capaz de gerar eletricidade, a energia solar é usada para muitas outras finalidades.
A figura a seguir mostra o uso da energia solar para dessalinizar a água. Nela, um tanque contendo água salgada é coberto por um plástico transparente e tem a sua parte central abaixada pelo peso de uma pedra, sob a qual se coloca um recipiente (copo). A água evaporada se condensa no plástico e escorre até o ponto mais baixo, caindo dentro do copo.
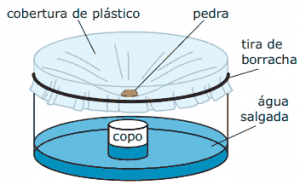
HINRICHS, R. A.; KLEINBACH, M. Energia e meio ambiente. São Paulo: Pioneira Thomson Learning, 2003 (Adaptação).
Nesse processo, a energia solar cedida à água salgada:
A) fica retida na água doce que cai no copo, tornando-a, assim, altamente energizada.
B) fica armazenada na forma de energia potencial gravitacional contida na água doce.
C) é usada para provocar a reação química que transforma a água salgada em água doce.
D) é cedida ao ambiente externo através do plástico, onde ocorre a condensação do vapor.
E) é reemitida como calor para fora do tanque, no processo de evaporação da água salgada.
Questão 09. (Enem–2010) Em nosso cotidiano, utilizamos as palavras “calor” e “temperatura” de forma diferente de como elas são usadas no meio científico. Na linguagem corrente, calor é identificado como “algo quente” e temperatura mede a “quantidade de calor de um corpo”. Esses significados, no entanto, não conseguem explicar diversas situações que podem ser verificadas na prática. Do ponto de vista científico, que situação prática mostra a limitação dos conceitos corriqueiros de calor e temperatura?
A) A temperatura da água pode ficar constante durante o tempo em que estiver fervendo.
B) Uma mãe coloca a mão na água da banheira do bebê para verificar a temperatura da água.
C) A chama de um fogão pode ser usada para aumentar a temperatura da água em uma panela.
D) A água quente que está em uma caneca é passada para outra caneca a fim de diminuir sua temperatura.
E) Um forno pode fornecer calor para uma vasilha de água que está em seu interior com menor temperatura do que a dele.
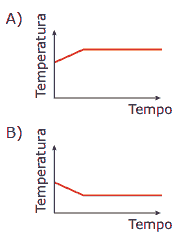
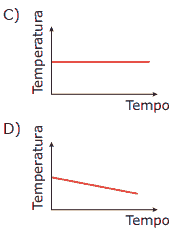
Questão 10. (UFMG) Exercícios sobre Termoquímica: Um béquer aberto, contendo acetona, é mergulhado em outro béquer maior, isolado termicamente, o qual contém água, conforme mostrado na figura.
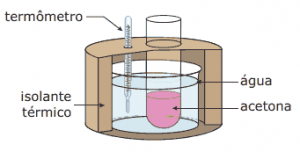
A temperatura da água é monitorada durante o processo de evaporação da acetona, até que o volume desta se reduz à metade do valor inicial. Assinale a alternativa cujo gráfico descreve qualitativamente a variação da temperatura registrada pelo termômetro mergulhado na água, durante esse experimento.
🔵 >>> Confira nossa lista com todos os exercícios de química.
Gabarito com as respostas dos Exercícios sobre Termoquímica para ir bem no Enem e Vestibular:
01. B;
02. C;
03. C;
04. B;
05. C;
06. D;
07. B;
08. D;
09. A;
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
