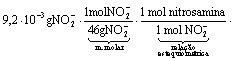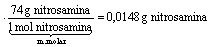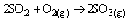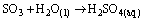Questão 01 sobre Massa Química: (Ufg GO/2008/2ªFase). A análise do enxofre contido numa amostra de sacarina ![]() pode ser realizada segundo as seguintes etapas:
pode ser realizada segundo as seguintes etapas:
1. inicialmente, o enxofre é convertido em íons sulfato;
2. a seguir, a solução que contém os íons sulfato é tratada com uma solução de cloreto de bário, formando-se um precipitado;
3. o precipitado resultante é separado por decantação;
4. a massa desse precipitado é determinada.
Considerando as etapas acima,
a) escreva a equação química que representa a formação do precipitado na etapa 2;
b) proponha um método alternativo para a etapa 3;
c) se a massa do precipitado for de 1,675g, quais serão a massa e o teor de enxofre na amostra?
Questão 02. (Unesp SP/2008/Exatas) Estudos recentes indicam que as águas do aqüífero Guarani (um dos maiores reservatórios subterrâneos de água doce conhecidos no planeta) estão sendo contaminadas. O teor de nitrogênio já atinge, em determinados locais, valores acima do nível de tolerância do organismo humano. Em adultos, o nitrogênio, na forma de nitrito, atua na produção de nitrosaminas e nitrosamidas, com elevado poder cancerígeno. Considerando as equações químicas a seguir,
![]() (produção do ácido nitroso no estômago)
(produção do ácido nitroso no estômago)
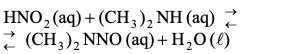 (produção da nitrosamina)
(produção da nitrosamina)
determine a massa da nitrosamina que pode ser produzida a partir de um litro de água cujo teor em nitrito seja igual a 9,2 mg. Apresente seus cálculos.
Questão 03 sobre Massa Química: (Uepg PR/2007/Janeiro). O ferro reage com o oxigênio do ar produzindo óxido de ferro (III), Fe2O3, popularmente conhecido como ferrugem. Este processo é chamado de corrosão.
No que respeita o apresentado, assinale o que for correto.
Dados: Fe=56 g/mol; O=16 g/mol
01. O estado de oxidação do ferro após a corrosão é +2.
02. Esta é uma reação de óxido-redução em que o ferro é agente oxidante.
04. A equação equilibrada desta reação é a seguinte: 4Fe(s) + 3O2(g) ![]() 2 Fe2O3 (s).
2 Fe2O3 (s).
08. A corrosão do ferro é acelerada se o mesmo for colocado em uma solução salina, devido à maior condutividade do meio.
16. Se uma amostra de ferro puro com uma massa de 2,8 g for inteiramente oxidada a Fe2O3, a quantidade de óxido produzida é de 4,0 g.
Questão 04. (Puc RS/2007/Julho) A nitração total do fenol está representada pela equação
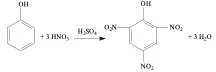
A massa de fenol, em gramas, necessária para reagir completamente com 18,9 g de ácido nítrico é, aproximadamente,
a) 9,4
b) 18,9
c) 25
d) 72
e) 94
Questão 05. (UFCG PB/2007/Julho. Alguns gases como o gás mostarda, o fosgênio, etc. são utilizados como arma de guerra devido ao alto grau de toxidez e de letalidade. A ação desses gases se deve à produção do ácido clorídrico, que é responsável pela irritação da pele, dos olhos e do sistema respiratório. No caso do fosgênio, a produção do ácido clorídrico é devido à equação não balanceada:
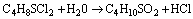
Admitindo que a dose letal gás fosgênio seja de 0,01 mg de HCl por kg de massa corporal, qual seria a quantidade aproximada de gás mostarda suficiente para matar uma pessoa com 70 kg ?
a) 0,76 mg.
b) 1,52 mg.
c) 152 mg.
d) 76 mg.
e) 700 mg.
Questão 06 sobre Massa Química: (Unimontes MG/2007/1ªFase). O alumínio metálico reage com o óxido de ferro, Fe2O3, segundo a equação:
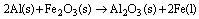
Essa reação é altamente exotérmica, chegando a fundir o ferro que é formado e, por isso, ela é utilizada para soldas. Partindo-se de 123 g de Fe2O3 e supondo a reação completa, a quantidade (g) de ferro líquido formada é, aproximadamente,
a) 172.
b) 43.
c) 86.
d) 112.
Questão 07. (Ufu MG/2007/2ªFase. O ácido sulfúrico, importante reagente químico produzido e consumido pelas indústrias químicas em todo o mundo, muitas vezes é empregado com indicativo de crescimento dos países. O processo industrial para obtenção do ácido sulfúrico envolve reações de oxi-redução a partir da matéria prima: o enxofre.
Pede-se:
a) escreva as três reações que mostram a obtenção do ácido sulfúrico.
b) explique por que esse ácido, quando comercializado, não é 100% puro.
c) calcule a massa aproximada de enxofre puro que deve ser utilizada para produzir um quilograma do ácido.
Questão 08 sobre Massa Química: (Unesp SP/2007/Conh. Gerais) A reação entre os gases hidrogênio e oxigênio libera energia que pode ser utilizada, por exemplo, em automóveis. A massa de água produzida por um automóvel movido a hidrogênio, após consumir 2 000 g deste gás, é
a) 2 000 g.
b) 16 000 g.
c) 18 000 g.
d) 32 000 g.
e) 36 000 g.
Questão 09. (Unesp SP/2007/Biológicas. O gás hilariante (N2O) é utilizado em alguns consultórios odontológicos assim como em alguns procedimentos cirúrgicos em hospitais. Uma maneira de produzir este gás consiste na decomposição térmica do nitrato de amônio, conforme a reação: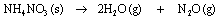
Sabendo que as massas molares do nitrato de amônio e do óxido nitroso correspondem, respectivamente, a 80 g.mol–1 e 44 g.mol–1, determine a massa de nitrato de amônio que deve ser utilizada para produzir 8,8 g de N2O.
Questão 10 sobre Massa Química: (Unesp SP/2007/Biológicas. Um grupo de estudantes de geologia coletou uma pedra em uma região rochosa, para a realização de estudos em laboratório. Suspeitando de que se tratava de CaCO3 puro, os estudantes inicialmente determinaram a massa da pedra, que era de 15,0 g. A pedra foi então submetida a forte aquecimento até que se transformou totalmente em um pó branco.
Supondo que eles tinham razão quanto à composição química e ao teor de pureza da pedra, qual deve ter sido a massa determinada do pó branco que obtiveram?
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios sobre Massa Química para enem:
b) Como se trata de um sistema heterogêneo, sólido-líquido, pode-se utilizar a filtração.
c) Massa: x = 0,230 g de S em 1,675 g de BaSO4
teor: x = 17,53%
03. 28;
04. A;
05. B;
06. C;
07.
b) Porque, por mais que se purifique o ácido, não se consegue retirar toda água, uma vez que o H2SO4 é uma substância higroscópica e consegue reter água em sua estrutura.
08. C;
09. 16 g NH4NO3;
10. 8,4 g CaO
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína