Questões sobre Propriedades Coligativas: 01. (UFMG–2009) Analise o gráfico a seguir, em que estão representadas as curvas de pressão de vapor em função da temperatura para três solventes orgânicos – éter etílico, CH3CH2OCH2CH3, etanol, CH3CH2OH, e tetracloreto de carbono, CCℓ4.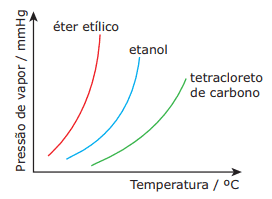
A partir da análise desse gráfico, é CORRETO afirmar que:
A) o CCℓ4 apresenta maior pressão de vapor.
B) o CCℓ4 apresenta menor temperatura de ebulição.
C) o etanol apresenta interações intermoleculares mais fortes.
D) o éter etílico apresenta maior volatilidade.
Questão 02. (UCB-DF / Adaptado) O gráfico a seguir representa a variação da pressão máxima de vapor dos líquidos A e B, em que A é uma solução (água + soluto não volátil) e B é água pura.
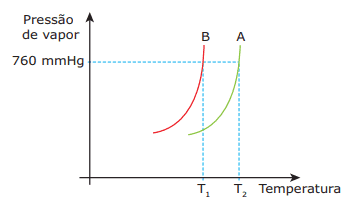
A partir dessas informações e a respeito das propriedades coligativas, assinale a alternativa INCORRETA.
A) Para uma mesma temperatura, a pressão de vapor do líquido B é maior que a do líquido A.
B) Considerando uma mesma pressão, a temperatura de ebulição do líquido A é maior que a do líquido B.
C) A pressão de vapor do líquido B diminuirá se a ele acrescentarmos um soluto não volátil qualquer.
D) Se o soluto não volátil do líquido A fosse o cloreto de sódio, a água na solução entraria em ebulição abaixo de 100 ºC (p = 760 mmHg).
Questão 03. (PUC Minas–2006) Certas propriedades físicas de um solvente, tais como temperatura de ebulição e de solidificação, são alteradas quando nele dissolvemos um soluto não volátil. Para se verificar esse fato, quatro sais distintos foram dissolvidos em frascos contendo a mesma quantidade de água, formando as soluções I, II, III e IV, como indica o esquema a seguir:
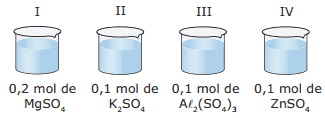
Assinale a alternativa que apresenta soluções em ordem crescente de abaixamento da temperatura de solidificação.
A) IV < I < II < III
B) III < I < II < IV
C) IV < II < I < III
D) III < II < I < IV
Questão 04. (Unimontes-MG–2009) A temperatura de ebulição da água, a 760 mmHg (T.E.), é 100 ºC, e algumas de suas soluções apresentam valores de T.E. mostrados na tabela a seguir:
| Soluções | Concentração / mol.L-1 | T.E. / C |
| Sacarose | 0,1 | 100,05 |
| Sacarose | 0,5 | 100,25 |
| NaCℓ | 0,1 | 100,1 |
| NaCℓ | 0,5 | 100,5 |
A análise dos dados da tabela revela que:
A) o aumento da temperatura de ebulição depende da natureza química do soluto.
B) o número de partículas em solução não influencia na temperatura de ebulição.
C) as moléculas de água em solução passam mais facilmente para o estado gasoso.
D) o valor de ΔT.E. é maior nas soluções de substâncias contendo ligações covalentes.
Questões sobre Propriedades Coligativas: 05. (UnB-DF) Os compartimentos A, B e C são iguais e separados por uma membrana semipermeável ao solvente. Em um dos compartimentos, colocou-se água destilada e, nos outros, igual volume de soluções de cloreto de sódio (sistema I).

Após algum tempo, os volumes iniciais se modificaram, como ilustrado no sistema II. Use essas informações e outras que forem necessárias para julgar os itens.
( ) A alteração dos volumes se deve à osmose.
( ) A concentração inicial das soluções é a mesma.
( ) A água destilada foi colocada no compartimento B.
( ) A pressão osmótica em A é maior que em C.
( ) As soluções têm a mesma pressão de vapor, a uma dada temperatura.
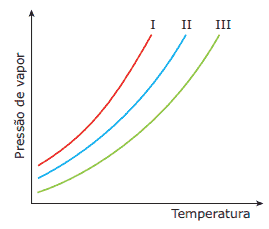
Questão 06. (UFTM-MG–2007) O gráfico apresenta as curvas de pressão de vapor em função da temperatura para três líquidos: I, II e III.
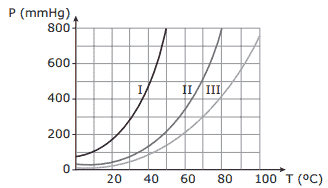
Sabendo-se que os líquidos são água, propanona e etanol, pode-se afirmar que:
A) a curva I corresponde ao etanol.
B) a água apresenta maior pressão de vapor.
C) a propanona apresenta ligações de hidrogênio como forças intermoleculares.
D) com a adição de um soluto não volátil, aumenta-se a pressão de vapor de qualquer um dos três líquidos.
E) o ponto de ebulição do etanol é próximo de 80 ºC.
Questão 07. (UFMG) Estudaram-se as variações das pressões de vapor da água pura e de uma solução aquosa diluída de sacarose (açúcar de cana), em função da temperatura.
O gráfico que descreve, qualitativamente, essas variações é:
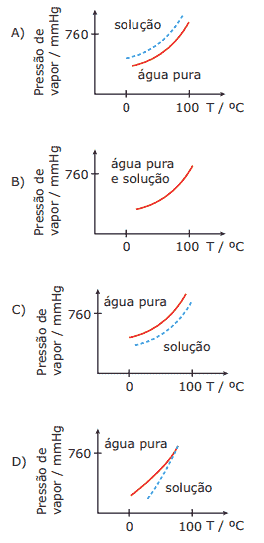
Questão 08. (UFSCar-SP) As curvas de pressão de vapor, em função da temperatura, para um solvente puro, uma solução concentrada e uma solução diluída são apresentadas na figura a seguir.
Considerando-se que as soluções foram preparadas com o mesmo soluto não volátil, pode-se afirmar que as curvas do solvente puro, da solução concentrada e da solução diluída são, respectivamente:
A) I, II e III.
B) I, III e II.
C) II, III e I.
D) II, I e III.
E) III, II e I.
Questão 09. (UFSCar-SP) A figura a seguir apresenta as curvas de pressão de vapor de três líquidos puros, 1, 2 e 3, em função da temperatura.
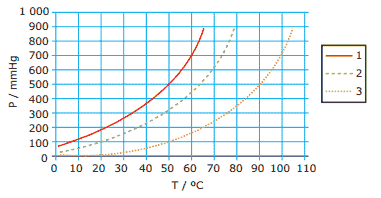
Considere que os líquidos estão submetidos à mesma pressão e analise as seguintes afirmações:
I. Quando os líquidos estão em suas respectivas temperaturas de ebulição, a pressão de vapor do líquido 1 é maior que a dos líquidos 2 e 3.
II. Quando se adiciona um soluto não volátil ao líquido 2, observa-se um aumento no seu ponto de ebulição.
III. Na temperatura ambiente, o líquido 3 é o mais volátil.
IV. A maior intensidade das forças intermoleculares no líquido 3 é uma explicação possível para o comportamento observado.
Está CORRETO apenas o que se afirma em:
A) I e II.
B) I e IV.
C) II e III.
D) II e IV.
E) III e IV.
Questões sobre Propriedades Coligativas: 10. (UNESP) Foram preparadas, em separado, soluções aquosas de concentração 1,0 mol.L-1 das seguintes substâncias: NaCℓ (cloreto de sódio); Na2O (óxido de sódio); C12H22O11 (sacarose). Os frascos foram numerados como 1, 2 e 3. Solicitou-se a um estudante que identificasse as soluções realizando experimentos no laboratório. Os resultados obtidos são apresentados na tabela a seguir.
| Solução | pH | Comportamento quanto à condutividade elétrica | Temperatura de ebulição |
| 1 | 7 | Isolante | T1 |
| 2 | maior que 7,0 | Condutor | T2 |
| 3 | 7 | Condutor | T3 |
Com base nas informações fornecidas, e sabendo que as equações químicas para as dissoluções são
NaCℓ(s) + H2O(ℓ) → Na+(aq) + Cℓ–(aq)
Na2O(s) + H2O(ℓ) → 2Na+(aq) + 2OH–(aq)
C12H22O11(s) + H2O(ℓ) → C12H22O11(aq)
é CORRETO afirmar que:
A) T1 < T2 < T3.
B) T1 < T3 < T2.
C) T2 < T1 < T3.
D) T2 < T3 < T1.
E) T3 < T1 < T2.
🔵 >>> Confira nossa lista com todos os exercícios de química.
Gabarito com as respostas das das Questões sobre Propriedades Coligativas para passar no Enem:
01. D;
02. D;
03. C;
04. A;
05. V, F, V, F, F;
06. E;
07. C;
08. B;
09. D;
10. B;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
