Questão 01 sobre Propriedades Coligativas Atividades: (UfU/2001) As substâncias que ocorrem na natureza encontram-se normalmente misturadas com outras substâncias, formando misturas homogêneas ou heterogêneas. As misturas homogêneas, ao contrário das heterogêneas, podem ser confundidas, na aparência, com substâncias puras. Uma forma de diferenciar as misturas homogêneas de substâncias puras é determinar as propriedades físicas do sistema em questão como ponto de fusão (PF), ponto de ebulição (PE), densidade e condutividade elétrica. Considerando esse fato, as seguintes afirmativas, em relação à água do mar, estão corretas, EXCETO:
a) a densidade da água do mar é maior que a densidade da água pura.
b) a água do mar tem pressão de vapor superior à da água pura.
c) a água do mar contém compostos iônicos e moleculares dissolvidos.
d) a água do mar congela numa temperatura inferior à da água pura.
Questão 02. (UFPE/2002) Por que a adição de certos aditivos na água dos radiadores de carros evita que ocorra o superaquecimento da mesma, e também o seu congelamento, quando comparada com a da água pura?
a) Porque a água mais o aditivo formam uma solução que apresenta ponto de ebulição e de fusão maiores que os da água pura.
b) Porque a solução formada (água + aditivo) apresenta pressão de vapor maior que a água pura, o que causa um aumento no ponto de ebulição e de fusão.
c) Porque o aditivo reage com a superfície metálica do radiador, que passa então a absorver energia mais eficientemente, diminuindo, portanto, os pontos de ebulição e de fusão quando comparados com a água pura.
d) Porque o aditivo diminui a pressão de vapor da solução formada com relação à água pura, causando um aumento do ponto de ebulição e uma diminuição do ponto de fusão.
e) Porque o aditivo diminui a capacidade calorífica da água, causando uma diminuição do ponto de fusão e de ebulição.
Questão 03. (ITA/2002) Explique por que água pura exposta à atmosfera e sob pressão de 1,0 atm entra em ebulição em uma temperatura de 100°C, enquanto água pura exposta à pressão atmosférica de 0,7 atm entra em ebulição em uma temperatura de 90°C.
Questão 04. (Unifesp/06) Na figura, são apresentadas duas curvas que expressam a relação entre a pressão de vapor de dois líquidos, A e B, e a temperatura. Um deles é uma solução aquosa de sacarose 1,0 mol/L e outro, água destilada.
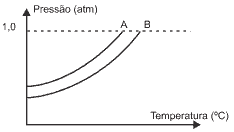
Considerando-se o comportamento da pressão de vapor em relação à temperatura de um terceiro líquido, C, uma solução aquosa de nitrato de alumínio, Al(NO3)3, 0,5 mol/L e das curvas A e B, são feitas as seguintes afirmações:
I. A curva da solução C deve se posicionar à esquerda da curva A.
II A temperatura de ebulição do líquido A é menor que a temperatura de ebulição do líquido B.
III. A solução C deve apresentar maior pressão de vapor que o líquido B.
IV. O líquido A é água destilada.
É correto apenas o que se afirma em
a) I e III.
b) IIIe IV.
c) II e III.
d) II e IV.
e) I e IV.,
Questão 05 sobre Propriedades Coligativas Atividades: (UFU/06) Considere três soluções diferentes, A, B e C, contendo cada uma delas 100,0 g de água e, respectivamente, 34,2 g de sacarose, 4,6 g de etanol e 4,0 g de hidróxido de sódio.
Massa molar
Sacarose, C12H22O11 342 g/mol
Etanol, C2H5OH 46 g/mol
Hidróxido de sódio, NaOH 40 g/mol
É correto afirmar que:
a) as três soluções têm os mesmos pontos de congelamento.
b) as soluções A e C têm o mesmo ponto de ebulição, mas a solução B tem o mais baixo.
c) a solução C tem o mais baixo ponto de congelamento do grupo de soluções.
d) o ponto de ebulição da solução C é mais baixo do que o das soluções A ou B.
Questão 06. (UEL/07) A adição de um soluto não-volátil a um solvente dificulta sua ebulição e seu congelamento. Isto pode ser útil na prática quando, por exemplo, se pretende cozinhar um ovo mais rápido ou então quando é necessário evitar o congelamento da água do radiador de carros em países muito frios. Considere as duas soluções aquosas de NaCl, conforme o quadro, e analise as afirmativas a seguir.

I. A solução B tem pressão de vapor menor que a da solução A, na mesma temperatura.
II. As soluções A e B apresentam pontos de ebulição menores que o da água pura.
III. Independentemente da quantidade de soluto, as duas soluções apresentam o mesmo ponto de ebulição.
IV. A solução B entra em ebulição a uma temperatura mais alta que a solução A.
Estão corretas apenas as afirmativas:
a) I e IV.
b) II e IV.
c) II e III.
d) I, II e III.
e) I, III e IV.
Questão 07. (PUC-MG/07) Em um laboratório, um estudante recebeu três diferentes amostras (X, Y e Z). Cada uma de um líquido puro, para que fosse estudado o comportamento de suas pressões de vapor em função da temperatura. Realizado o experimento, obteve-se o seguinte gráfico da pressão de vapor em função da temperatura:

Considerando-se essas informações, é CORRETO afirmar que:
a) o líquido Z é aquele que apresenta maior volatilidade.
b) o líquido X é o que apresenta maior temperatura de ebulição ao nível do mar.
c) as forças de atração intermoleculares dos líquidos aumentam na ordem: X < Y < Z.
d) a temperatura de ebulição do líquido Z, à pressão de 700 mmHg, é 80°C.
Questão 08. (UFMG/07) O oxigênio e o enxofre formam, com o hidrogênio, respectivamente, as substâncias H2O e H2S.
A 25°C e 1 atm de pressão, a água é líquida e o sulfeto de hidrogênio é gasoso. Considerando-se essas informações, é CORRETO afirmar que, na situação descrita, a diferença de estado físico das duas substâncias está relacionada ao fato de:
a) a ligação covalente S—H ser mais forte que a O—H.
b) a massa molar de H2S ser menor que a de H2O.
c) a pressão de vapor de H2O ser menor que a de H2S.
d) a temperatura de ebulição de H2S ser maior que a de H2O.
Questão 09. (UFMG/07) Um balão de vidro, que contém água, é aquecido até que essa entre em ebulição. Quando isso ocorre,
– desliga-se o aquecimento e a água para de ferver;
– fecha-se, imediatamente, o balão; e, em seguida,
– molha-se o balão com água fria; então,
– a água, no interior do balão, volta a ferver por alguns segundos.
Assim sendo, é CORRETO afirmar que, imediatamente após o balão ter sido molhado, no interior dele:
a) a pressão de vapor da água aumenta.
b) a pressão permanece constante.
c) a temperatura da água aumenta.
d) a temperatura de ebulição da água diminui.
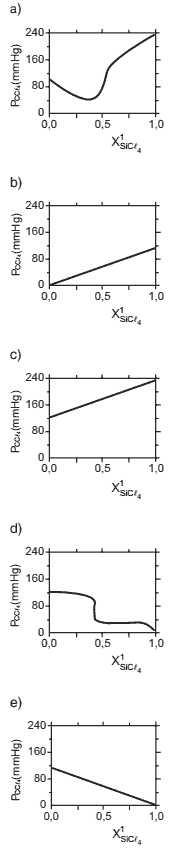
Questão 10 sobre Propriedades Coligativas Atividades: (ITA/06) Considere soluções de SiCl4 / CCl4 de frações molares variáveis, todas a 25°C. Sabendo que a pressão de vapor do CCl4 a 25°C é igual a 114,9 mmHg, assinale a opção que mostra o gráfico que melhor representa a pressão de vapor de CCl4 (PCCl4) em função da fração molar de SiCl4 no líquido (X1 SiCl4) .
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado de química sobre Propriedades Coligativas Atividades:
01. b;
02. d;
03. A pressão de vapor de uma substância aumenta com o aumento da temperatura.
Quando a pressão de vapor se iguala à pressão local (pressão atmosférica., o líquido entra em ebulição; portanto, em um local onde a pressão atmosférica é 0,7 atm, a água entra em ebulição em uma temperatura menor que 100°C.
04. d;
05. c;
06. a;
07. c;
08. c;
09. d;
10. e
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
