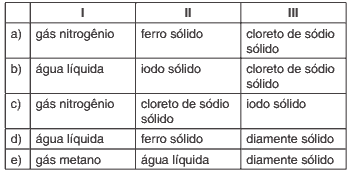
Questões 01 sobre Ligações Metálicas e Alotropia: (Fuvest-2016) Existem vários modelos para explicar as diferentes propriedades das substâncias químicas, em termos de suas estruturas submicroscópicas.
Considere os seguintes modelos:
I. moléculas se movendo livremente;
II. íons positivos imersos em um “mar” de elétrons deslocalizados;
III. íons positivos e negativos formando uma grande rede cristalina tridimensional.
Assinale a alternativa que apresenta substâncias que exemplificam, respectivamente, cada um desses modelos.
Questões 02. (Unifae – 2016) Em um jogo desenvolvido para avaliar o conhecimento de alunos a respeito dos elementos químicos, o objetivo é ligar os símbolos de elementos para formar uma figura. Para isso, são fornecidas instruções, como: conecte um elemento metálico de transição presente na liga mais utilizada pela construção civil com o halogênio mais reativo da Classificação Periódica.
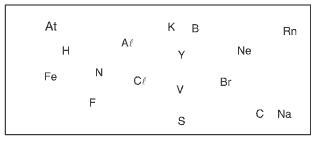
(Journal of chemical education, maio de 2003. Adaptado.)
Considerando o quadro e seguindo a instrução fornecida, devem ser conectados os elementos:
a) ferro e flúor.
b) alumínio e cloro.
c) ferro e cloro.
d) alumínio e flúor.
e) carbono e flúor.
Questões 03. (UERJ-2015) Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais apresentados na tabela a seguir:
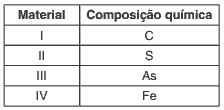
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo seguinte número:
a) I
b) II
c) III
d) IV
Questões 04 sobre Ligações Metálicas e Alotropia: (FACISB) O diamante, estrutura cristalina representada na figura, é constituído por átomos de carbono. A forte interação entre esses átomos é responsável pela extrema dureza do diamante.
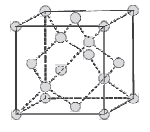
(http://www.infoescola.com. Adaptado.)
A interação entre os átomos de carbono na estrutura do diamante é do tipo
a) dipolo-dipolo.
b) ligação covalente.
c) ligação iônica.
d) ligação metálica.
e) ligação de hidrogênio.
Questões 05. (UEM-2015) Assinale o que for correto.
1) Os seguintes processos são exemplos de transformações químicas: a) queima do carvão; b) caramelização do açúcar e c) efervescência de um comprimido antiácido.
2) É possível classificar como sistemas heterogêneos todos os seguintes sistemas: a) ouro + areia; b) bronze; c) água líquida + gelo; d) ar atmosférico + poeira e e) granito.
04) A alotropia refere-se à formação de duas ou mais substâncias pelo arranjo de átomos de um mesmo elemento químico. São exemplos de alótropos: oxigênio e ozônio; gelo e água líquida; grafite e diamante; fósforo branco e fósforo vermelho.
08) Considerando que uma latinha de refrigerante vazia tenha em média 14 gramas, é possível inferir que existem aproximadamente 3 × 1023 átomos de alumínio em cada lata.
16) Um átomo de alumínio (Z = 13) possui número de massa igual a 27. Consequentemente existem 40 nêutrons em seu núcleo.
Questões 06. (Unimontes 2014) O carbono apresenta dois alótropos de formas cristalinas distintas: o grafite e o diamante, como pode ser observado nas figuras a seguir:
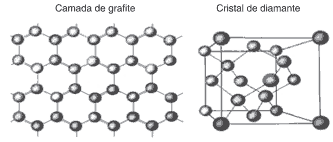
À temperatura ambiente e pressão atmosférica normal, o grafite é a forma estável do carbono. Assim, poderíamos considerar que o diamante, então, naturalmente, transformar-se-ia em grafite; no entanto, isso apenas ocorre à taxa zero ou a uma temperatura de 1500°C, sob vácuo, para felicidade dos possuidores desse material. Considerando as características desses alótropos, é CORRETO afirmar que:
a) o grafite e o diamante apresentam temperaturas de fusão baixas.
b) o grafite e o diamante apresentam redes cristalinas covalentes.
c) o cristal de grafite apresenta uma rede tridimensional irregular.
d) os átomos de carbono, no diamante, estão unidos em hexágonos.
Questões 07 sobre Ligações Metálicas e Alotropia: (Mackenzie 2014) Uma ferramenta originalmente desenvolvida para computadores quânticos agora é capaz de mapear mudanças de temperatura dentro de uma célula viva. A técnica explora efeitos quânticos em minúsculos cristais de diamante, ou “nanodiamantes”, para detectar alterações de alguns milésimos de grau. Além disso, os pesquisadores conseguiram aquecer partes selecionadas da célula com um laser. O diamante revelou ser um material útil para lidar com informações quânticas, armazenando qubits (bit quântico) em sua estrutura de cristais de carbono como se fossem elétrons de impurezas. Tipicamente, as impurezas compreendem um átomo de nitrogênio que substituiu um dos átomos de carbono e uma lacuna, ou “vaga”, de um único átomo ao lado do nitrogênio.
Os pesquisadores manipularam com sucesso esses “ocos” de nitrogênio — o que foi um passo para usá-los para realizar cálculos quânticos. Como os elétrons do nitrogênio são extremamente sensíveis a campos magnéticos, os cristais de diamante também se mostraram promissores para o imageamento por ressonância magnética.
http://www2.uol.com.br/sciam/noticias/nanotermometro_mede_temperatura_de_celulas_vivas.html
Como base nos seus conhecimentos, é INCORRETO afirmar que o diamante:
a) é formado por átomos de carbono.
b) é uma variedade alotrópica do átomo de carbono.
c) é um isótopo do átomo de carbono-12.
d) tem sua disposição estrutural geométrica diferente da estrutura geométrica do grafite.
e) apresenta propriedades físico-químicas diferentes das propriedades do grafite.
Questões 08. (Uema 2014) O gás ozônio e o fósforo branco são alótropos dos elementos químicos oxigênio (z = 8) e fósforo (z = 15), respectivamente, que apresentam diferentes características. O jornal O Estado do Maranhão veiculou as seguintes informações sobre essas duas formas alotrópicas:
“BRASIL – A região metropolitana de São Paulo atingiu em 2012 o pior índice de poluição por ozônio (O3) nos últimos 10 anos, segundo relatório anual de qualidade do ar da CETESB
(Companhia Ambiental do Estado de São Paulo).”
Fonte: O Estado do Maranhão. São Luís: Mirante, 23 mai. n. 18.545. 2013.
“ISRAEL – Autoridades militares israelenses voltaram a afirmar que o país deve interromper o uso de munições de artilharia com fósforo branco (P4), utilizado para criar cortinas de fumaça. As munições devem ser substituídas por outras que usariam apenas gases para causar o mesmo efeito. Grupos de direitos humanos condenaram o uso de armas com fósforo branco durante o conflito de Gaza, por elas causarem sérios danos à população civil. Ele é utilizado, além de ocultar movimento de tropas com uma cortina de fumaça, para marcar alvos inimigos ou até mesmo incendiar os oponentes. Seus efeitos podem ser mortais. Em contato com a pele, a substância causa queimaduras que vão até o osso.”
Fonte: O Estado do Maranhão. São Luís: Mirante, 28 mai. n. 18.550. 2013.
As características químicas desses alótropos são as seguintes:
a) o gás ozônio é molécula polar; o fósforo branco é molécula apolar.
b) a molécula do gás ozônio é paramagnética; a do fósforo branco é diamagnética.
c) a molécula do gás ozônio apresenta geometria tetraédrica; a do fósforo branco, trigonal plana.
d) o gás ozônio e o fósforo branco são alótropos que apresentam ligações simples e dupla entre os seus átomos.
e) o gás ozônio e o fósforo branco são alótropos de elementos químicos que pertencem ao mesmo grupo na tabela periódica.
Questões 09 sobre Ligações Metálicas e Alotropia: (Uece 2014) Segundo o artigo “Grafeno será o silício do século 21?” do físico Carlos Alberto Santos, publicado na edição on-line da revista Ciência Hoje, “o grafeno é uma forma de carbono, uma folha com espessura de alguns átomos, constituindo o que é conhecido como estrutura genuinamente bidimensional. Se for enrolado na forma de um canudo, recebe o nome de nanotubo de carbono. Se for manipulado para formar uma bola, é conhecido como fulereno”.
Sobre o carbono e suas formas cristalinas, assinale a única afirmação verdadeira.
a) As diversas estruturas como grafite, diamante, grafeno e fulereno são isótopos do carbono.
b) O grafeno é tido como o substituto do silício, por ser um semicondutor, ser mais resistente e mais abundante na natureza.
c) A estrutura do grafeno apresenta átomos densamente compactados e hibridação do tipo sp2.
d) A única forma cristalina do carbono que apresenta condutibilidade elétrica é o grafite.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das atividades de química para enem sobre Ligações Metálicas e Alotropia:
01. a;
02. a;
03. d;
04. b;
05. 01 + 08 = 09
06. b;
07. c;
08. a;
09. c
A estrutura do grafeno apresenta átomos densamente compactados e hibridação do tipo sp2:
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
