Questão 01 sobre Termoquímica: (Elite) Observe o esquema a seguir:

De acordo com o esquema acima, este processo pode ser considerado:
a) exotérmico e absorve 900kJ.
b) exotérmico e libera 200kJ.
c) exotérmico, com ∆H = –900kJ.
d) endotérmico, com ∆H = +200kJ.
e) endotérmico, com ∆H = –200kJ.
Questão 02. (Elite) Assinale a alternativa que contém apenas processos com ∆H negativo.
a) Combustão e fusão.
b) Combustão e sublimação de sólido para gás.
c) Combustão e sublimação de gás para sólido.
d) Fusão e ebulição.
e) Evaporação e congelação.
Questão 03. Modelo Enem. Uma lata de spray esfria quando é agitada ou quando lançamos no ambiente a substância contida no frasco. Esse fenômeno ocorre porque:
a) há vaporização do líquido e esse processo é endotérmico.
b) há liquefação do vapor e esse processo é exotérmico.
c) há solidificação do líquido e esse processo é endotérmico.
d) há ebulição do líquido e esse processo é exotérmico.
e) há sublimação.
Questão 04 sobre Termoquímica: (Elite) Observe o processo de vaporização da água:
H2O(l) H2O(g)
∆H = +44KJ/mol
Determine o calor absorvido na vaporização de 0,9g de água.
(Dados: H = 1,0; O = 16)
Questão 05. (Elite) É característico de uma reação exotérmica apresentar:
a) reagentes e produtos líquidos.
b) entalpias iguais para reagentes e produtos.
c) apenas participantes gasosos.
d) entalpia dos produtos menor que a entalpia dos reagentes.
e) entalpia dos produtos maior que a entalpia dos reagentes.
Questão 06. (Elite) A queima de 1 mol de carbono libera 94kcal, enquanto a vaporização de 1 mol de água absorve 10kcal.
Qual massa de água poderia vaporizar com a queima de 48g de carbono?
(Dadas as massas molares: Carbono = 12g/mol; H2O = 18g/mol)
Questão 07 sobre Termoquímica: (Elite) Observe o diagrama a seguir:
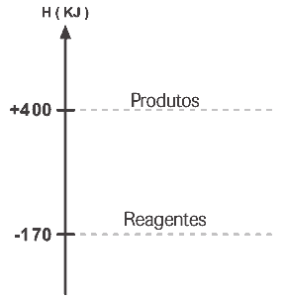
É possível afirmar que:
a) o processo é exotérmico, com ∆H = +230kJ.
b) o processo é endotérmico, com ∆H = +570kJ.
c) o processo é endotérmico, com ∆H = +230kJ.
d) o processo é exotérmico, com ∆H = –230kJ.
e) o processo é exotérmico, com ∆H = –570kJ.
Questão 08. (Elite) O mercúrio pode ser obtido pela reação de cinábrio, HgS (sulfeto de mercúrio), com oxigênio do ar.

Com base nessas informações, responda:
a) A entalpia dos reagentes é maior ou menor que a entalpia dos produtos? Por quê?
b) Qual o calor liberado na formação de 4,0g de mercúrio? (Dado: Hg = 200)
Questão 09. Dado o diagrama de entalpia:
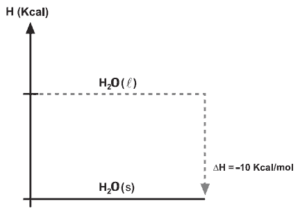
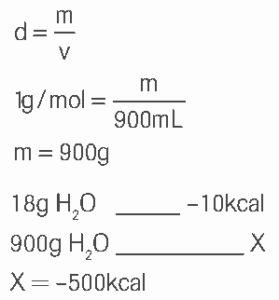
Determine o calor de ∆H na solidificação de 900mL de água. (Dados: densidade da água líquida = 1,0g/mL; massa molar de água = 18g/mol)
Questão 10 sobre Termoquímica: (Elite) Defina:
a) processo exotérmico;
b) processo endotérmico.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com atividades de química sobre a Termoquímica:
01. B;
02. C;
03. A;
04. 1 mol = 16 + 2 . 1 = 18g
18g _____ 44kJ
0,9g _______ X
X = 2,2kJ
05. D;
06. 12g de carbono _____ 94kcal
48g de carbono _________ X
X = 376kcal
18g de H2O _____ 10kcal
Y _____ 376kcal
Y = 678,8g de H2O
07. B;
08.
a) O processo apresenta ∆H negativo (processo exotérmico), então, ocorre liberação de energia e a entalpia
dos reagentes é maior que a entalpia dos produtos.
b) 200g de Hg _____ –238kJ
4g de Hg ___________ X
X = –4,76kJ
09.
10.
a) Libera calor para o ambiente e transmite a sensação de aquecimento.
b) Absorve calor do ambiente e transmite a sensação de frio.
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
