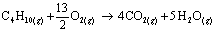Questão 01 sobre Volume: (Ueg GO/2008/Janeiro). A água oxigenada pode apresentar aspecto viscoso em altas concentrações (100 volumes), sendo usada, nesse caso, em laboratórios e indústrias. Na concentração de 10 volumes, pode ser usada como agente bactericida e, em gargarejos, tem a finalidade antisséptica.

Sobre a concentração e os efeitos da água oxigenada, é CORRETO afirmar:
a) Para produzir 1 L de solução de água oxigenada a 10 volumes são necessários 25 g de H2O2.
b) Ao ser aplicada na pele tem-se a falsa impressão de que ocorre uma fervura. Isso ocorre em virtude do calor da pele e da basicidade da parte subcutânea que acelera o processo de decomposição, liberando gás oxigênio.
c) O peróxido de hidrogênio é líquido e iônico como todos os demais óxidos dessa classe.
d) A água oxigenada apresenta ponto de ebulição inferior ao da água nas mesmas condições de pressão e é um poderoso agente redutor que pode sofrer combustão espontânea em contato com matéria orgânica.
Questão 02. (Uem PR/2008/Janeiro) De acordo com a reação abaixo, qual é o volume aproximado de hidrogênio formado ao se reagirem 50 g de zinco com excesso de ácido clorídrico a uma pressão de 4,3 atm e temperatura de 150 ºC?
(Dados: R = 0,082 atml mol−1 K−1)
a) 0,769l
b) 2,2l
c) 22l
d) 6,2l
e) 62,1l
Questão 03 sobre Volume: (UFCG PB/2008/Janeiro). O uso do fogo na agricultura é condenado há mais de um século pelos manuais de conservação do solo, pois provoca conseqüências negativas na produtividade da terra. No Brasil, desde o início da colonização, as queimadas foram utilizadas para a preparação de áreas para o plantio da cana de açúcar, do cacau e da monocultura como um todo, sendo o fogo ateado para a destruição de campos e florestas. O sociólogo Gilberto Freyre afirma que “o canavial desvirginou todo esse mato grosso de modo mais cru pela queimada. A cultura da cana valorizou o canavial e tornou desprezível a mata”. Para plantar a cana, o ferro e o fogo tornaram-se “parceiros” do senhor de engenho, cerrando a floresta e desvirginando a Mata Atlântica. O inconseqüente uso do fogo para as práticas agropastoris e para a abertura de locais de habitação humana, sempre foi uma das identidades do Brasil que queima, que corta, que cerra e que destrói.
Adaptado de FERREIRA, Manoel Eduardo. A queimada da cana e seu impacto socioambiental. Disponível em: http://www.adital.com.br. Acesso em 6 jul. 2007
Admitindo que a madeira é constituída de aproximadamente 50% em massa de celulose (polímero formado por unidades repetidas de glicose (C6H12O6)) e admitindo ainda que a queimada de um hectare (10.000 m2) da mata atlântica provoca a combustão de 30 toneladas de madeira, responda as questões abaixo considerando a combustão completa da glicose.
a) Escreva a equação química balanceada da reação de combustão da glicose.
b) Determine a massa de glicose proveniente de uma área de caatinga equivalente a um campo de futebol de 100m x 50m.
c) Determine o volume, em metros cúbicos, de gás carbônico produzido, medido nas condições normais de temperatura e pressão, pela queimada de uma área de caatinga equivalente a um campo de futebol de 100m x 50m.
Questão 04. (Unesp SP/2008/Biológicas) Um procedimento muito utilizado para eliminação de bactérias da água é a adição de cloro com produção de hipoclorito. O cloro pode ser produzido pela eletrólise de uma solução aquosa de íons cloreto, segundo a equação I:
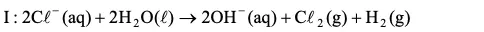
Posteriormente, o Cl2 pode reagir com as hidroxilas produzindo o hipoclorito.
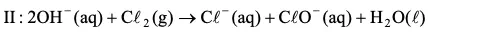
Calcule o volume de H2 produzido nas CNTP quando ocorre o consumo de 117,0 gramas de NaCl (massa molar = 58,5 g.mol–1) de acordo com a Equação I, e forneça a equação global que expressa a formação de hipoclorito a partir da eletrólise da solução de cloreto.
Questão 05. (Unesp SP/2008/Exatas) Uma das principais fontes de energia térmica utilizadas atualmente no Estado de São Paulo é o gás natural proveniente da Bolívia (constituído principalmente por metano). No entanto, devido a problemas políticos e econômicos que causam eventuais interrupções no fornecimento, algumas empresas estão voltando a utilizar o GLP (gás liquefeito de petróleo, constituído principalmente por butano).
Forneça as equações químicas para a combustão de cada um desses gases e calcule os volumes de cada um deles que produzem 22,4 litros de CO2.
Questão 06 sobre Volume: (Uff RJ/2007/1ªFase) A água oxigenada (H2O2) também usada em salões de beleza é vendida em recipientes escuros ou em plásticos opacos. Isso é devido ao fato de a luz ser um dos fatores responsáveis por sua decomposição, na qual ocorre a liberação de O2(g). Desse modo, as concentrações das soluções de água oxigenada são definidas em razão do volume de O2(g) liberado nas CNTP por unidade de volume da solução. Logo, uma água oxigenada a 10 volumes, sendo usada, libera 10 litros de O2(g) por litro de solução.
Considerando a informação, a massa em grama de água oxigenada que libera 10 litros de O2(g) nas CNTP será:
a) 15,2
b) 22,4
c) 30,3
d) 34,0
e) 60,6
Questão 07. (Uem PR/2007/Janeiro). Sabe-se que alguns automóveis são equipados com airbags, bolsas de ar que se inflam em caso de acidente. O ar que enche a bolsa é proveniente de uma reação química entre nitreto de sódio e nitrato de potássio de acordo com a equação química
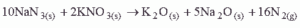
Considerando o N2 um gás ideal e considerando o sistema nas CNTP, a massa aproximada de NaN3(s) necessária para se encher um airbag de 60 litros é
a) 0,16 g.
b) 108 g.
c) 37,5 g.
d) 1,67 g.
e) 358,4 g.
Questão 08 sobre Volume: (Ufg GO/2007/1ªFase). A água oxigenada é vendida como uma solução de peróxido de hidrogênio (H2O2) em água (H2O). O peróxido se decompõe lentamente em O2 e H2O. Essa solução apresenta uma concentração medida em volumes (V), ou seja, 1 L de solução de água oxigenada 10 V é capaz de liberar 10 L de O2, a 0° C e 1 atm, quando decomposta. Assim, pode-se afirmar que o número de mols de O2 produzidos pela decomposição de 1 L de uma solução de água oxigenada 20 V é
a) 0,04
b) 0,45
c) 0,89
d) 1,12
e) 17,8
Questão 09. (Unesp SP/2007/Biológicas) O Brasil ainda é carente de investimentos na reciclagem de lixo urbano e em programas de conscientização dos problemas causados especialmente pelos resíduos sólidos. Queimadas de lixo são freqüentes em terrenos baldios, especialmente em centros urbanos. Quando queimamos restos de embalagens e de canos de PVC, por exemplo, provocamos a liberação de um ácido forte na forma de gás para a atmosfera.
Sabendo que a fórmula do monômero do PVC é H2C = CHCl e as massas molares de H = 1 g.mol–1, C = 12 g.mol–1 e Cl = 35,5 g.mol–1, calcule a massa e o volume, nas condições normais de temperatura e pressão, do ácido que é produzido na queima de 625 g de PVC, considerando que todo o cloro tenha sido convertido em HCl.
Questão 10 sobre Volume: (Ufam AM/2007). A reação de transformação do oxigênio em ozônio envolve cinco moléculas ao todo. Cada nove mols de oxigênio consumido na reação libera:
a) 22,4×1023 mols de ozônio
b) 3,01×1024 moléculas de ozônio
c) 45 mols de ozônio totais
d) 96 g/mol de ozônio
e) 134,4 litros de ozônio nas CNTP
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre Volume Cálculo Estequiométrico:
01. B;
02. D;
b) 7,5 toneladas
c) 5.600 m3 de CO2
04. Volume: 22,4 L H2
metano: 22,4 L CH4
butano: 5,6 L C4H10
06. C;
07. B;
08. C;
09. massa: 365 g HCl e o volume: 224 L HCl;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína