Questão 01 sobre Acidez e Basicidade: Das moléculas CH4, CH3Cl, CH2Cl2, CHCl3, CCl4 e CCl3F, quais são polares e quais são apolares? Justifique a resposta.
Questão 02. (Elite) Em termos de Eletronegatividade, como é possível prever a polaridade de uma ligação química?
Questão 03. (Elite) Uma molécula com ligações polares é necessariamente polar? Justifique.
Questão 04. (Elite) O que são as forças intermoleculares? Quais são elas?
Questão 05 sobre Acidez e Basicidade: (Cesgranrio) Analise os compostos seguintes quanto à ocorrência de ligações e/ou forças intra e intermoleculares. Em seguida, assinale a opção correta:
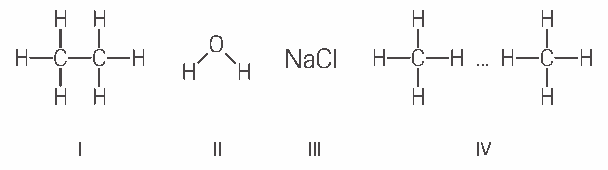
a) Em I, observam-se ligações eletrovalentes e, em IV, ligações covalentes e pontes de hidrogênio.
b) Em I, observam-se ligações eletrovalentes, e em III, ligação covalente.
c) Em II, observam-se pontes de hidrogênio e, em IV, forças de Van der Waals.
d) Em II e IV, observam-se ligações covalentes e pontes de hidrogênio.
e) Em III, observa-se ligação iônica, e em IV, pontes de hidrogênio.
Questão 06. (PUC) Considere as seguintes substâncias:
I. C12H22O11
II. C12H26
III. C6H5COOH
IV. C6H5COO–Na+
V. C10H8
Considerando a natureza das ligações químicas, pode-se prever que apresenta maior temperatura de fusão a substância:
a) I
b) II
c) III
d) IV
e) V
Questão 07 sobre Acidez e Basicidade: (Cesgranrio) Determina-se experimentalmente que, num álcool R-OH, a solubilidade com o tamanho de R, esse fato se deve:
a) somente às propriedades hidrófilas do radical hidroxila.
b) às propriedades hidrófilas de R, qualquer que seja seu tamanho.
c) às propriedades hidrófobas de R, qualquer que seja seu tamanho.
d) ao fato de o aumento de R corresponder ao aumento da parte apolar hidrofóbica.
e) ao fato de a diminuição de R corresponder a uma diminuição na polaridade da molécula.
Questão 08. (PUC) Nas condições ambientes, a substância líquida, volátil, combustível, que dissolve bem a parafina, imiscível com a água deve ser:
a) etano.
b) heptano.
c) etanol.
d) C60H122
e) metanol.
Questão 09. (UFES) Com relação aos compostos orgânicos e inorgânicos, é incorreto afirmar que:
a) Os compostos orgânicos geralmente apresentam ponto de ebulição maior que os compostos inorgânicos.
b) os compostos orgânicos geralmente apresentam ponto de fusão menor que os compostos inorgânicos.
c) os compostos inorgânicos são geralmente mais solúveis em água que os compostos orgânicos.
d) os organismos vivos são constituídos por grande quantidade de compostos orgânicos.
e) nem todo composto que apresenta carbono em sua estrutura é composto orgânico.
Questão 10 sobre Acidez e Basicidade: (Elite) As substâncias orgânicas são, em geral, pouco densas. Explique.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões de química sobre Acidez e Basicidade dos Compostos Orgânicos:
01. Polares: CH3Cl; CH2Cl2; CHCl3; CCl3.
São apolares: CH4 ; CCl4.
02. A polaridade de uma ligação química será tanto maior quanto maior for a diferença de eletronegatividade entre seus átomos.
03. Não, pois isso dependerá da resultante dos vetores de polarização representados por suas ligações.
04. As forças intermoleculares surgem em consequência da maior ou menor polaridade das moléculas.
→ forças dipolo-dipolo: ocorrem quando há uma atração forte entre o pólo positivo de uma molécula e o pólo negativo da molécula vizinha.
→ Forças de Van der Waals: são forças fracas que atraem entre si as moléculas apolares.
→ Pontes de hidrogênio: são atrações fortes que aparecem entre o átomo de hidrogênio e átomos fortemente eletronegativos, como F, O e N.
05. C
06. D. Os sólidos iônicos apresentam maior temperatura de fusão.
07. D. Quanto maior a cadeia, menor a solubilidade, pois a parte –OH é bem solúvel, mas R – não.
08. B. A parafina é um hidrocarboneto, então deve ser solúvel em heptano.
09. A. Compostos orgânicos são mais voláteis.
10. As moléculas orgânicas são pouco densas, pois são formadas principalmente por carbono e hidrogênio, (C= 12 ; H = 1) que possuem massas atômicas baixas.
Cabe ressaltar as atrações entre as moléculas orgânicas serem, em geral, fracas.
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
