Questão 01 sobre Polaridade das Moléculas e das Ligações Químicas: (Puccamp 2016) O quartzo é um mineral cuja composição química é SiO2, dióxido de silício. Considerando os valores de eletronegatividade para o silício e oxigênio, 1,8 e 3,5 respectivamente, e seus grupos da tabela periódica (o silício pertence ao grupo 14 e o oxigênio ao grupo 16), prevê-se que a ligação entre esses átomos seja:
a) covalente apolar.
b) covalente coordenada.
c) covalente polar.
d) iônica.
e) metálica.
Questão 02. (UFRS) O momento dipolar é a medida quantitativa da polaridade de uma ligação. Em moléculas apolares, a resultante dos momentos dipolares referentes a todas as ligações apresenta valor igual a zero.
Entre as substâncias covalentes a seguir:
I – CH4
II – CS2
III – HBr
IV – N2
quais as que apresentam a resultante do momento dipolar igual a zero?
a) Apenas I e II.
b) Apenas II e III.
c) Apenas I, II e III.
d) Apenas I, II e IV.
e) I, II, III e IV.
Questão 03 sobre Polaridade das Moléculas e das Ligações Químicas: (Espcex (Aman) 2016) O carvão e os derivados do petróleo são utilizados como combustíveis para gerar energia para maquinários industriais. A queima destes combustíveis libera grande quantidade de gás carbônico como produto. Em relação ao gás carbônico, são feitas as seguintes afirmativas:
I – é um composto covalente de geometria molecular linear.
II – apresenta geometria molecular angular e ligações triplas, por possuir um átomo de oxigênio ligado a um carbono.
III – é um composto apolar.
Das afirmativas apresentadas está(ão) correta(as)
a) apenas II.
b) apenas I e II.
c) apenas I e III.
d) apenas II e III.
e) todas.
Questão 04. (Uea 2014) A queima de florestas é uma das imagens mais negativas do Brasil no exterior. Durante a queima são liberadas toneladas de gás carbônico (CO2), um dos gases do efeito estufa. A derrubada de florestas altera o equilíbrio ecológico da região, interferindo no ciclo das chuvas (precipitação de H2O) e na fertilidade do solo. Pode-se afirmar corretamente que as geometrias moleculares e as polaridades das moléculas de água e de gás carbônico são, respectivamente:
a) linear e polar; angular e apolar.
b) angular e apolar; linear e apolar.
c) angular e polar; linear e polar.
d) angular e polar; linear e apolar.
e) linear e apolar; angular e polar.
Questão 05 sobre Polaridade das Moléculas e das Ligações Químicas: (FGV) O conhecimento das estruturas das moléculas é um assunto bastante relevante, já que as formas das moléculas determinam propriedades das substâncias como odor, sabor, coloração e solubilidade. As figuras apresentam as estruturas das moléculas CO2, H2O, NH3, CH4, H2S e PH3.
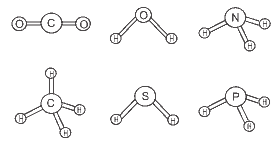
Quanto à polaridade das moléculas consideradas, as moléculas apolares são:
a) H2O e CH4.
b) CH4 e CO2.
c) H2S e PH3.
d) NH3 e CO2.
e) H2S e NH3.
Questão 06. (Uepg 2015) Considerando as representações abaixo, assinale o que for correto quanto às ligações químicas desses compostos:
Dados:
H(Z = 1); O(Z = 8); S(Z = 16); Cl(Z = 17);
K(Z = 19); Ca(Z = 20); I(Z = 53).
I. H2S
II. O2
III. CaCl2
IV. KI
01) O composto III é um sal inorgânico formado por ligação iônica.
02) O composto II tem moléculas de geometria linear formadas por ligação covalente apolar.
04) O composto I é um ácido inorgânico com ligações do tipo covalente polar.
08) O composto IV, quando puro, é um líquido à temperatura ambiente e essa característica se deve ao tipo de ligação química apresentada.
Questão 07 sobre Polaridade das Moléculas e das Ligações Químicas: (PUC-RS) O dióxido de carbono possui molécula apolar, apesar de suas ligações carbono-oxigênio serem polarizadas. A explicação para isso está associada ao fato de:
a) a geometria da molécula ser linear.
b) as ligações ocorrerem entre ametais.
c) a molécula apresentar dipolo.
d) as ligações ocorrerem entre átomos de elementos diferentes.
e) as ligações entre os átomos serem de natureza eletrostática.
Questão 08. (UFPE) Considerando os seguintes haletos de hidrogênio HF, HCl e HBr, pode-se afirmar que:
a) a molécula mais polar é HF.
b) a molécula mais polar é HCl.
c) todos os três são compostos iônicos.
d) somente HF é iônico, pois o flúor é muito eletronegativo.
e) somente HBr é covalente, pois o Bromo é um átomo muito grande para formar ligações iônicas.
Questão 09. (Fuvest) A figura mostra modelos de algumas moléculas com ligações covalentes entre seus átomos.
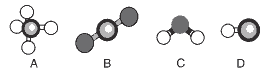
Analise a polaridade dessas moléculas, sabendo que tal propriedade depende da:
• diferença de eletronegatividade entre os átomos que estão diretamente ligados. (Nas moléculas apresentadas, átomos de elementos diferentes têm eletronegatividades diferentes.)
• forma geométrica das moléculas.
(Observação: Eletronegatividade é a capacidade de um átomo para atrair os elétrons da ligação covalente.)
Dentre essas moléculas, pode-se afirmar que são polares apenas:
a) A e B
b) A e C
c) A, C e D
d) B, C e D
e) C e D
Questão 10 sobre Polaridade das Moléculas e das Ligações Químicas: (UFF) A capacidade que um átomo tem de atrair elétrons de outro átomo, quando os dois formam uma ligação química, é denominada eletronegatividade. Esta é uma das propriedades químicas consideradas no estudo da polaridade das ligações. Assinale a opção que apresenta, corretamente, os compostos H2O, H2S e H2Se em ordem crescente de polaridade.
a) H2Se < H2O < H2S.
b) H2S < H2Se < H2O.
c) H2S < H2O < H2Se.
d) H2O < H2Se < H2S.
e) H2Se < H2S < H2O.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios de química sobre Polaridade das Moléculas e das Ligações Químicas:
01. c;
02. d;
03. c;
04. d;
05. b;
06. 01 + 02 + 04 = 07.
[01] Correta. O é um sal inorgânico, que apresenta um metal em sua fórmula, sendo, portanto, um composto iônico.
[02] Correta. O composto formado por possui geometria linear (formado por 2 átomos apenas. e como são átomos iguais a ligação será covalente apolar.
[04] Correta. O ácido sulfídrico é um ácido inorgânico, com geometria angular, cuja resultante será diferente de zero, portanto um composto polar.
[08] Incorreta. O iodeto de potássio é formado por ligações iônicas, sendo assim, possui altos pontos de fusão e ebulição, sendo, portanto, um composto sólido a temperatura ambiente.
07. a;
08. a;
09. e;
10. e
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
