Questão 01. (Uel PR/2002) Exercícios sobre Geometria Molecular: Considere o texto e a figura a seguir.
A geometria de uma molécula é importante porque define algumas propriedades do composto, como a polaridade, a solubilidade, o ponto de fusão e ebulição, caracterizando sua aplicação.
O fosgênio COCl2 é empregado na obtenção dos policarbonatos, que são plásticos utilizados na fabricação de visores para astronautas, vidros à prova de bala e CDs.
A amônia é extremamente solúvel em água e no estado líquido é utilizada como solvente. O tetracloreto de carbono é um líquido quimicamente pouco reativo, sendo bom solvente de óleos, gorduras e ceras. As estruturas dos três compostos citados estão representadas abaixo.
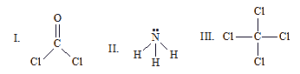
Dados os números atômicos: H (Z=1); C (Z=6); N (Z=7); O (Z=8); Cl (Z=17).
Com relação à geometria das moléculas I, II e III, na figura acima, é correto afirmar:
a) Todas são planas.
b) Todas são piramidais.
c) Apenas I e II são planas.
d) Apenas I é plana.
e) Apenas II é espacial.
Questão 02. (ITA SP/2000) Assinale a opção que contêm a geometria molecular CORRETA das espécies OF2 , SF2 , BF3 , NF3 , CF4 e XeO4 , todas no estado gasoso.
a) Angular , linear, piramidal, piramidal, tetraédrica e quadrado planar.
b) Linear, linear, trigonal plana, piramidal, quadrado planar quadrado planar.
c) Angular, angular, trigonal plana, piramidal, tetraédrica e tetraédrica.
d) Linear, angular, piramidal, trigonal plana, angular e tetraédrica.
e) Trigonal plana, linear, tetraédrica, piramidal, tetraédrica e quadrado planar.
Questão 03. (IME RJ/2006) Um composto de fórmula molecular AB5 é constituído por elementos que pertencem ao mesmo período de um determinado gás nobre. Tal gás nobre apresenta a mesma distribuição eletrônica que um íon de um dado nuclídeo X. Sabe-se ainda que o nuclídeo X contém 21 prótons, 21 elétrons e 24 nêutrons.
O elemento A é não-metálico e não pertence ao grupo dos calcogênios. Nas CNTP, A encontra-se no estado sólido e B existe como molécula diatômica.
Responda e justifique:
a) a que período os elementos A e B pertencem?
b) qual é a carga do íon do núclídeo X?
c) o composto AB5 é covalente ou iônico?
d) os elementos A e B pertencem a quais grupos ou famílias?
e) qual é o nome do composto AB5?
f) qual é a forma geométrica do composto AB5, considerando o modelo de repulsão dos pares de elétrons da camada de valência?
g) quais são os orbitais híbridos necessários ao elemento A para acomodar os pares de elétrons no arranjo geométrico do item anterior?
Questão 04. (Puc MG/1994) Considerando as transformações:
a. C(grafite) + O2 ® CO2
I II
b. CO2 + H2O ® H2CO3
III
Os átomos de carbono em I, II e III apresentam, respectivamente, geometrias:
a) digonal, digonal, trigonal.
b) trigonal, digonal, trigonal.
c) trigonal, digonal tetraédrica.
d) tetraédrica, digonal, trigonal.
e) trigonal, tetraédrica e digonal.
Questão 05. (Unesp SP/2004/Exatas) Exercícios sobre Geometria Molecular: Os fornos de microondas são aparelhos que emitem radiações eletromagnéticas (as microondas) que aquecem a água e, conseqüentemente, os alimentos que a contêm. Isso ocorre porque as moléculas de água são polares, condição necessária para que a interação com esse tipo de radiação seja significativa. As eletronegatividades para alguns elementos são apresentadas na tabela a seguir.
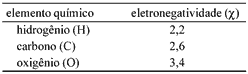
a) Com base nessas informações, forneça a fórmula estrutural e indique o momento dipolar resultante para a molécula de água.
b) Sabendo que praticamente não se observam variações na temperatura do dióxido de carbono quando este é exposto à ação das radiações denominadas microondas, forneça a estrutura da molécula de CO2. Justifique sua resposta, considerando as diferenças nas eletronegatividades do carbono e do oxigênio.
Questão 06. (Ufrn RN/1995) A molécula resultante da ligação de oxigênio e flúor é representada pela fórmula:
Dado: número atômico: O = 8; F = 9
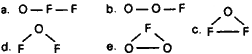
Questão 07. (Ufal AL/1998) O ácido hipocloroso é representado pela estrutura:
Dado: número atômico: H = 1; Cl = 17; O = 8
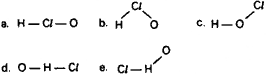
Questão 08. (FCChagas BA/1994) Qual das seguintes formulações é a mais correta para representar a forma da molécula de NF3?
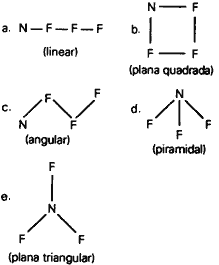
Questão 09. (Unificado RJ/1995) As geometrias das moléculas PH3 e H2S são, respectivamente:
Dado: número atômico: H = 1; P = 15; S = 16.
a) trigonal plana e linear;
b) tetraédrica e linear;
c) piramidal trigonal e angular;
d) quadrada plana e triangular plana;
e) tetraédrica e trigonal plana.
Questão 10. (Cesgranrio RJ/1997) Exercícios sobre Geometria Molecular: Assinale o item que apresenta a única espécie de estrutura linear:
a) H2O
b) C6H5CH2CH3
c) CO2
d) NH3
e) H2SO4
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos Exercícios sobre Geometria Molecular:
01. D;
02. C;
OF2 -> Angular.
SF2 -> Angular.
BF3 -> Trigonal plana.
NH3 -> Piramidal.
CF4 -> Tetraédrica.
XeO4 -> Tetraédrica.
03. a. A e B pertencem ao 3º período.
b. X apresenta carga +3.
c. AB5 é covalente pela pequena diferença de eletronegatividade de A e B.
d. A-> família 5A ou grupo 15B -> família 7A ou grupo 17.
e. AB5 -> pentacloreto de fósforo.
f. AB5 -> bipiramidal ou bipirâmide trigonal.
g. A -> apresenta hibridação sp3d ou dsp3.
04. B;
05. 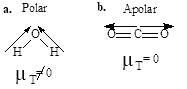
06. D;
07. C;
08. D;
09. C;
10. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína

estou gostando das atividades, muito complexa e de bastante ultilidades para o cotidiano de uma boa aprendizagem os exercicios sao de fixaçao,de revisao, e realmente tirando as duvidas que as pessoas sempre tem em relaçao as materias
Olá Valderi. Que bom que gostou do conteúdo. Muito obrigado pelo seu comentário.