Questão 01 sobre Hipótese de Avogadro: (Fuvest/99) Certo gás X é formado apenas por nitrogênio e oxigênio. Para determinar sua fórmula molecular, comparou-se esse gás com o metano (CH4). Verificou-se que volumes iguais dos gases X e metano, nas mesmas condições de pressão e temperatura, pesaram, respectivamente, 0,88 g e 0,32 g. Qual a fórmula molecular do gás X?
Massas Molares (g/mol): H = 1; N = 14; C = 12; O = 16.
a) NO.
b) N2O.
c) NO2.
d) N2O3.
e) N2O5.
Questão 02. (Mack/99) O gás hidrogênio foi utilizado, no início do século, em balões conhecidos como “Zeppelins”. Atualmente, balões de publicidade e balões para crianças são enchidos com gás hélio. Relativamente ao gás hélio, é INCORRETO afirmar que (Dados: massas molares (g/mol): H = 1; He = 4.):
a) tem densidade maior que o ar atmosférico.
b) sua massa molar é maior do que a do gás hidrogênio.
c) é um gás não inflamável.
d) tem fórmula molecular: He.
e) é um gás mais denso do que o gás hidrogênio.
Questão 03 sobre Hipótese de Avogadro: (Puccamp) Tanto em comemorações esportivas como na prática do balonismo como esporte, bexigas e balões dirigíveis são cheios com gases que apresentam determinadas propriedades. Dentre as substâncias gasosas a seguir:
I – Hélio: menos denso do que o ar e praticamente inerte;
II – Dióxido de Carbono: mais denso do que o ar e incombustível;
III – Criptônio: praticamente inerte e mais denso do que o ar;
IV – Hidrogênio: combustível e menos denso do que o ar;
V – Monóxido de Carbono: combustível e de densidade próxima à do ar; a mais segura para ser utilizada em balões e bexigas é
a) I.
b) II.
c) III.
d) IV.
e) V.
Questão 04. (Unifesp/2008) Amostras dos gases oxigênio e dióxido de enxofre foram coletadas nos frascos idênticos A e B, respectivamente. O gás trióxido de enxofre pode se formar se ocorrer uma reação entre os gases dos frascos A e B, quando estes são misturados em um frasco C.
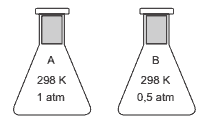
Sobre esses gases, são feitas as seguintes afirmações:
I. O frasco A apresenta o dobro de moléculas em relação ao frasco B.
II. O número de átomos do frasco B é o dobro do número de átomos do frasco A.
III. Ambos os frascos, A e B, apresentam a mesma massa.
IV. Considerando que a reação ocorreu por completo, o frasco C ainda contém gás oxigênio. São corretas as afirmações
a) I, II, III e IV.
b) I, II e III, somente.
c) I, II e IV, somente.
d) I, III e IV, somente.
e) II, III e IV, somente.
Questão 05 sobre Hipótese de Avogadro: (Unicamp/2008) Após a limpeza do banheiro, Rango foi à sala e removeu todos os móveis e, de tão feliz e apaixonado, começou a cantarolar: “Beijando teus lindos cabelos, Que a neve do tempo marcou… Estavas vestida de noiva, Sorrindo e querendo chorar…” De repente, volta à realidade lembrando que tinha que limpar aquela sala de 50 m2 e de 3 m de altura, antes que Dina voltasse. “Hoje a temperatura está em 32°C e a pressão atmosférica na sala deve ser, aproximadamente, 4 vezes o valor da minha pressão arterial sistólica (180 mmHg ou aproximadamente 21.000 Pa), sem medicação. Ah, se eu fosse tão leve quanto o ar dessa sala!”, pensava Rango…
a) “Se o ar se comporta como um gás ideal, quantos mols dessa mistura gasosa devem estar presentes aqui na sala?”
b) “Se minha massa corpórea é de 120 kg, e eu acho que estou fora do peso ideal, então, se eu tivesse a mesma massa que o ar dessa sala, eu estaria melhor? Por quê?”.
(Dados: constante dos gases = 8,314 Pa m3 mol-1 . K-1, T/K = 273 + t/°C; o ar é composto de, aproximadamente, 78% em massa de nitrogênio, 21% de oxigênio, 1,0% de argônio.)
Questão 06. (UFC/2010) A reação de explosão da nitroglicerina acontece quando este composto é submetido a uma onda de choques provocada por um detonador, causando sua decomposição de acordo com a reação:
4 C3H5(NO3)3(l) → 6 N2(g) + O2(g) + 12 CO2(g) + 10 H2O(g)
Considerando que esta reação ocorre a 1,0 atm e a 298,15 K e que os gases gerados apresentam comportamento ideal, assinale a alternativa que corretamente indica o volume total (em L) de gás produzido quando ocorre a explosão de quatro moles de nitroglicerina.
Dado: R = 0,082 atm L mol-1 K-1.
a) 509.
b) 609.
c) 709.
d) 809.
e) 909.
Questão 07. (ITA/2010) Um vaso de pressão com volume interno de 250 cm3 contém gás nitrogênio (N2) quimicamente puro, submetido à temperatura constante de 250°C e pressão total de 2,0 atm. Assumindo que o N2 se comporta como gás ideal, assinale a opção CORRETA que apresenta os respectivos valores numéricos do número de moléculas e da massa específica, em kg m-3, desse gás quando exposto às condições de pressão e temperatura apresentadas.
a) 3,7 x 1021 e 1,1.
b) 4,2 x 1021 e 1,4.
c) 5,9 x 1021 e 1,4.
d) 7,2 x 1021 e 1,3.
e) 8,7 x 1021 e 1,3.
Questão 08 sobre Hipótese de Avogadro: (UFG/2010) Leia o trecho a seguir.
Entre os atuais problemas ambientais estão a chuva ácida, a poluição atmosférica e o efeito estufa, sendo o último causado por gases como o dióxido de carbono e o metano. Por outro lado, as substâncias que contribuem para o aumento da poluição atmosférica são óxidos de nitrogênio, monóxido de carbono, dióxido de enxofre e compostos aromáticos.
A figura a seguir mostra o gráfico das emissões de um motor à gasolina em função da mistura ar/combustível, operando em condições de mistura: deficiente, estequiométrica e rica em oxigênio.
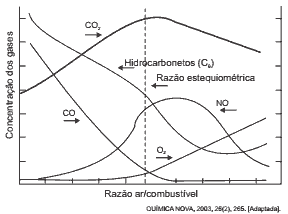
Com base nas informações apresentadas:
a) justifique em qual condição de mistura o motor emite as menores quantidades dos gases responsáveis pelo efeito estufa;
b) por que as quantidades de monóxido de carbono e de hidrocarbonetos são menores no lado direito do gráfico?
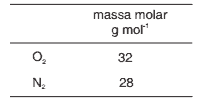
Questão 09. (Fuvest-2011) Maçaricos são queimadores de gás utilizados para produzir chamas de elevadas temperaturas, como as requeridas para soldar metais. Um gás combustível, muito utilizado em maçaricos, é o acetileno, C2H2, sendo que a sua combustão pode ser promovida com ar atmosférico ou com oxigênio puro.
a) Escreva a equação química balanceada da combustão completa do acetileno com oxigênio puro.
b) Em uma oficina de solda, existem dois cilindros idênticos, um deles contendo oxigênio puro (cilindro A) e o outro, ar atmosférico (cilindro B). Sabendo que, no interior dos dois cilindros, as condições de pressão e temperatura são as mesmas, qual dos dois cilindros contém a maior massa gasosa? Explique.
c) A temperatura da chama do maçarico é maior quando se utiliza a mistura de oxigênio e acetileno do que quando se usa a mistura de ar atmosférico e acetileno, mesmo estando os reagentes em proporção estequiométrica nos dois casos. Considerando as substâncias gasosas que recebem o calor liberado na combustão, em cada caso, explique essa diferença de temperatura.
Questão 10 sobre Hipótese de Avogadro: (UESC/2011) A pressão exercida pelo propano, C3H8(g), um propelente, no interior de uma embalagem de 200,0mL de tinta spray, é 1,5 atm, a 27°C.
Admitindo-se que o propano se comporta como gás ideal, ocupa 50% do volume da embalagem e que a quantidade de vapor produzido por qualquer outra substância, no interior da embalagem, é desprezível, é correto afirmar:
a) A pressão no interior da embalagem é igual a 2,0atm quando a temperatura aumenta para 127°C.
b) A efusão do propano causa o aquecimento da válvula que controla a saída de tinta do spray.
c) A tinta que se espalha no ar, durante a pintura de um objeto, forma uma solução gasosa.
d) O número de moléculas de propano no interior da embalagem é igual a 3,0 . 1021.
e) A massa de propelente existente no interior da embalagem é 0,2g.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões de química para vestibular sobre Hipótese de Avogadro:
Resposta da atividade 01. b;
Resposta da atividade 02. a;
Resposta da atividade 03. a;
Resposta da atividade 04. a;
Resposta da atividade 05. a) 4.969 mols de ar.
b) Rango estaria mais distante do peso ideal se possuísse massa equivalente à do ar da sala (≈ 144 kg).
Resposta da atividade 06. c;
Resposta da atividade 07. d;
Resposta da atividade 08. a) Mistura deficiente em oxigênio. Como o CO2 resulta da combustão, menos oxigênio representa menos combustão e, consequentemente, menos dióxido de carbono é produzido.
b) O lado direito representa a condição de mistura rica em oxigênio e, em decorrência, de combustão completa. Consequentemente, maior será a conversão dos hidrocarbonetos presentes no combustível em CO2, reduzindo a quantidade de monóxido produzido.
Resposta da atividade 09. a) Equação química balanceada da combustão completa do acetileno com oxigênio puro: 2 C2H2 + 5 O2 → 4 CO2 + 2 H2O
b) Como as condições de pressão, temperatura e volume são iguais, os dois cilindros contêm o mesmo número de mols de moléculas. Para um mol de moléculas, teremos:
Massa molar média do ar = 28,9 g/mol.
Massa molar do oxigênio = 32 g/mol.
O cilindro de oxigênio puro contém uma massa maior.
c) Como a porcentagem de oxigênio é maior no oxigênio puro do que no ar, a energia liberada será maior na queima do acetileno na presença do oxigênio puro. Na queima do acetileno com gás oxigênio puro, o calor liberado será absorvido pela água e pelo gás carbônico. Já no caso da queima do acetileno na presença de ar, o calor liberado será absorvido pela água, pelo gás carbônico e pelo gás nitrogênio (maior número de substâncias), logo a temperatura do sistema será menor.
Resposta da atividade 10. a
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
